APLICACION MEDICA
Anemia Falciforme y Toxicidad del Monóxido de Carbono
Lic. Raúl Hernández M.
Estructura Cuaternaria
Lic. Raúl Hernández M.
Contenidos:
1. Introducción2. Estructura Terciaria y Grupo Hemo
3. Anemia Falciforme
4. Toxicidad del Monóxido de Carbono
5. Estructura Cuaternaria
Introducción
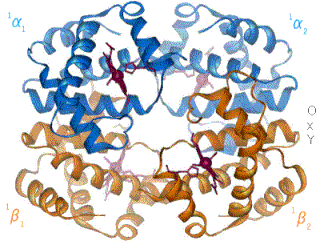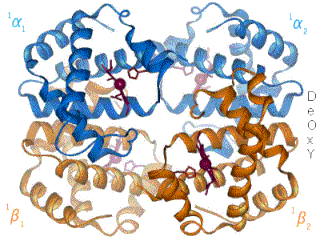
La proteína tetramérica al lado derecho es la hemoglobina A en su estado oxigenado, constituída por dos cadenas de globina alfa (α) y dos beta (β), codificada por un gen de globina α y β respectivamente. La hemoglobina, es la más eficiente transportadora de O2 conocida, se encuentra en concentraciones muy altas dentro de los glóbulos rojos de los humanos y casi todos los demás vertebrados. También está presente en algunos invertebrados, disuelta directamente en su sangre. La hemoglobina oxigenada dentro de los glóbulos rojos es responsable de transportar el oxígeno adquirido a través del intercambio de gases en los capilares pulmonares de los pulmones a las células de todo el cuerpo. La liberación de oxígeno de la hemoglobina proporciona a estas células el oxígeno adecuado para la respiración celular y restaura la hemoglobina a un estado desoxigenado.
La estructura de la proteína de hemoglobina y los cofactores de hemo asociados le confiere la notable capacidad de unirse y liberar oxígeno molecular (O2) en condiciones apropiadas. Esta exposición es una introducción a las relaciones estructura-función de la hemoglobina, la patología de un tipo de enfermedad de células falciformes que pueden producir algunas mutaciones en el gen de la β globina y la base molecular de la toxicidad del monóxido de carbono.
Estructura Terciaria y Grupo Hemo
Cada subunidad α y β comparte una estructura terciaria compuesta principalmente de hélices α.
Los dos dímeros ( α1β1 y α2β2) se asocian para formar un tetrámero.
Cada una de las cuatro subunidades de hemoglobina A lleva un cofactor hemo planar, detallado aquí para una de las subunidades α. Los hemos son pigmentos que dotan a la hemoglobina de su color rojo brillante y su capacidad para unirse y liberar oxígeno. Cada hemo consiste en un átomo central de hierro (Fe) mantenido en un anillo aromático de porfirina. El Fe existe en un estado cargado e ionizado, coordinado por cuatro átomos de nitrógeno en el centro del anillo.
El Fe esta anclado a cada subnidad de globina por un enlace covalente dativo, o coordinado, a una cadena lateral de histidina, nombrada como F8 o histidina proximal. Un enlace coordinado se produce cuando participa un átomo que proporciona dos electrones para formar el enlace covalente. La histidina F8 es el octavo residuo de la hélice F en ambas cadenas de globina α y β.
El O2 está enlazado reversiblemente al Fe del grupo hemo por medio de un enlace coordinado. La unión de O2 da como resultado una disposición de "extremo doblado": un átomo de oxígeno se une a un Fe y el otro oxígeno sobresale en un ángulo. Otro residuo de histidina, el E7 o histidina distal, es el 7o residuo de la hélice E y sirve para estabilizar el O2 unido. En una globina desoxigenada, una molécula de H2O toma el lugar del O2. Aunque la hemoglobina puede transportar otros gases como el dióxido de carbono y óxido nítrico, estos no están unidos por el hemo, sino por cadenas laterales en otras partes de la proteína.
Al unirse el O2 en los capilares pulmonares, en donde la presión parcial de oxígeno es alta, un monómero de globina cambia de forma debido a un movimiento del Fe del grupo hemo de una posición ligeramente "inferior" del plano de grupo hemo a una posición en el plano del grupo hemo. Esto atrae a la histidina F8 (proximal) hacia el grupo hemo, como se puede ver alternando entre una subunidad α entre su estado desoxigenado (desoxi) y oxigenado (oxi).
A medida que la histidina F8 cambia, toda la hélice F también se mueve, alterando ligeramente la conformación del monómero de globina.
Por lo tanto, la unión del O2 a la cadena de globina puede generar un desplazamiento de la histidina F8, un movimiento de la hélice F, y una alteración sutil de la subunidad. Esta situación genera un cambio conformacional de todo el tetrámero de hemoglobina, lo que facilita la unión del O2 a otras subunidades. Este efecto se produce porque los extremos carboxi de las hélices F que contienen la histidina F8 de cada subunidad de globina se encuentra cerca de la interfaz de los dímeros α1β1 y α2β2.
A medida que la hemoglobina llega a los tejidos con menor presión parcial de O2 y este se libera, un cambio conformacional OXI >> DESOXI de una subunidad es transmitido a las otras subunidades del tetrámero, alterando la estructura de la proteína y estimulando la liberación de O2 por otras subunidades.
El mecanismo notablemente eficiente de captación y administración de oxígeno se conoce como unión/liberación cooperativa, y el O2 puede considerarse como un regulador alostérico del tetrámero de hemoglobina.
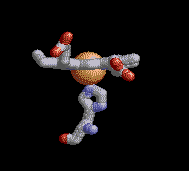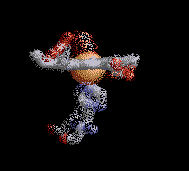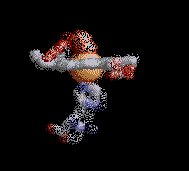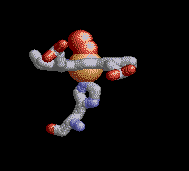
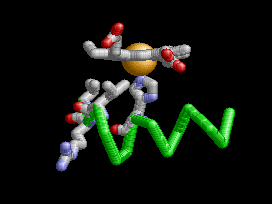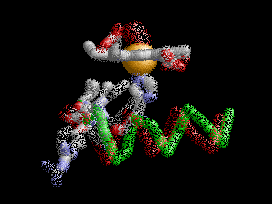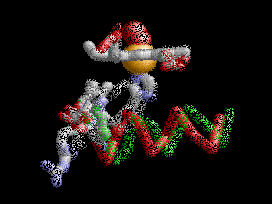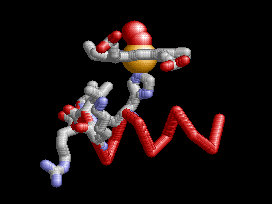
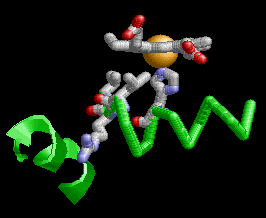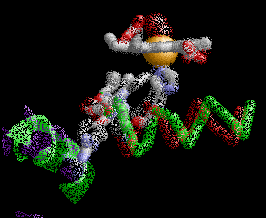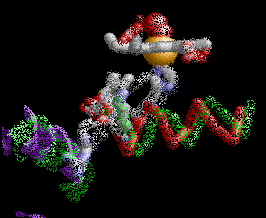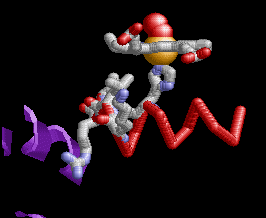
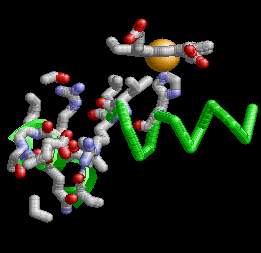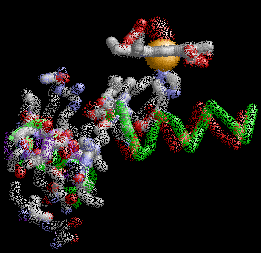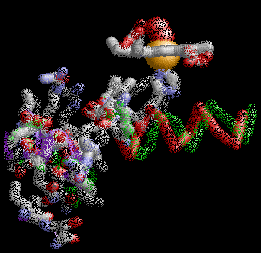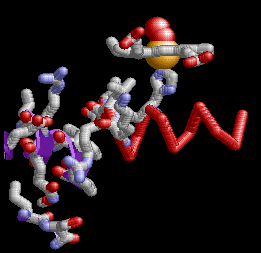
Anemia Falciforme
La desoxihemoglobina se muestra a la derecha, con las dos cadenas α y dos cadenas β sobresaltadas y los grupos hemo que carecen de oxígeno unido.
Como la mayoría de las otras proteínas en un ambiente celular acuoso, el tetrámero de Hemoglobina A tiene una preponderancia de aminoácidos polares/cargados en su superficie, donde sus cadenas laterales polares pueden formar enlaces débiles con moléculas polares de agua (H2O) que rodean la proteína globular soluble, los hidrógenos del ( H2O no se muestran, los oxígenos del H2O no se muestran a escala, y en la realidad habrían muchas más moléculas de H2O rodeando la proteína). Sin embargo, también existen algunos residuos hidrofóbicos en la superficie de la proteína o cerca de ella.
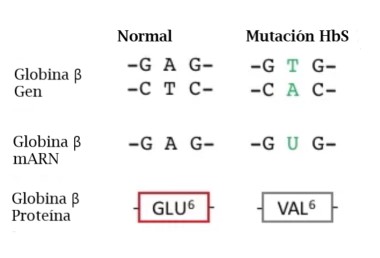
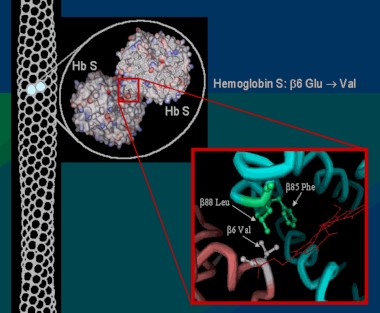
Un pequeño grupo de estos residuos hidrofóbicos forma un bolsillo en la superficie de ambas cadenas β de globina. Estos bolsillos desempeñan un papel esencial en la patología de una forma de anemia de células falciforme (del inglés: SCA), también conocida como enfermedad de HbS. Un segundo aspecto importante para entender la base molecular de SCA es un residuo de ácido glutámico en la posición 6 de las cadenas de globina β (GLU6).
La estructura de la derecha muestra dos tetrámeros de hemoglobina que están "dimerizados", que representan el comienzo de una cadena de tetrámeros de hemoglobina "polimerizada" que pueden formar largas fibras o hebras en los glóbulos rojos de pacientes con anemia de células falciformes (SCA). La formación de estas hebras causa una deformación de los glóbulos rojos normalmente en forma de disco en células en forma de media luna ("falciformes") que pueden alojarse en capilares pequeños, bloqueando así el flujo sanguíneo y por lo tanto el suministro de oxígeno a los tejidos periféricos (ver Figura abajo). SCA puede ser una enfermedad debilitante con síntomas de dolor intenso y daño tisular a largo plazo. Tenga en cuenta que los dos tetrámeros de hemoglobina están unidos por el contacto de una subunidad β de cada una, como se detalla a continuación.
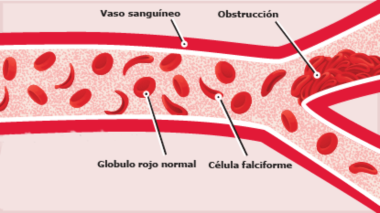
La Hemoglobina SCA (Hemoglobina S) es causada por un alelo mutante del gen de la hemoglobina B (HbS). La mutación de transversión de HbS codifica una subunidad β de hemoglobina con una valina hidrofóbica en la posición 6 (VAL6) en lugar del ácido glutámico estándar (GLU6). Dado que la GLU6 es un aminoácido de superficie, la mutación HbS da como resultado una subunidad β con una cadena lateral de VAL hidrofóbica en lugar de la cadena lateral normal y polar de GLU que sobresale de la superficie de la proteína interactuando con moléculas polares de H2O. Termodinámicamente, este es un estado desfavorable. por lo tanto, la VAL6 mutante de una subunidad β en un tetrámero de hemoglobina minimiza el contacto con el solvente H2O al empacar en un bolsillo superficial hidrofóbico complementario de una cadena β de otro tetrámero de hemoglobina. La "unión" hidrofóbica de las subunidades de HbS mutantes en los tetrámeros de hemoglobina S conduce a la agregación de los monómeros de hemoglobina en fibras largas e insolubles de que deforman los glóbulos rojos. Esta es la base molecular de SCA. La SCA es solo una de varios tipos de anemia falciforme. Otras SCD son causadas por diferentes mutaciones de globina.
Dado que cada subunidad de HbS de β globina tiene una VAL6 y un bolsillo hidrofóbico complementario, esto ofrece la oportunidad para que las proteínas mutantes de Hemoglobina S se unan a múltiples tetrámeros asociados, formando así fibras multicadena que tienen una estructura semi-helicoidal.
Un trasplante de sangre y médula ósea es actualmente la única cura para la enfermedad de células falciformes, y solo un pequeño número de personas pueden recibir el trasplante. Existen tratamientos efectivos que pueden reducir los síntomas y prolongar la vida. El diagnóstico precoz y la atención médica regular para prevenir complicaciones también contribuyen a mejorar el bienestar. La enfermedad de células falciformes es una enfermedad de por vida. La gravedad de la enfermedad varía ampliamente de persona a persona.
Toxicidad del Monóxido de Carbono
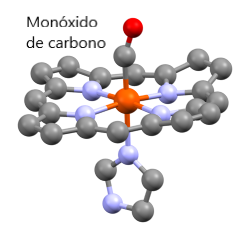
Como se indicó anteriormente, la hemoglobina puede transportar otros gases además del oxígeno. El dióxido de carbono y el óxido nítrico son ejemplos de gases que pueden nacer por la hemoglobina independientemente de los cofactores del hemo. Sin embargo, el monóxido de carbono (CO) se une al Fe de los poros de la porfirina de la hemoglobina, compitiendo directamente con el oxígeno. Este gas es altamente tóxico: la afinidad de unión de la hemoglobina por el CO es ~ 200 veces más fuerte que su afinidad por el oxígeno. La toxicidad extrema del CO radica en su capacidad para afectar la estructura cuaternaria de la hemoglobina. Incluso a bajas presiones parciales, la unión de CO por el hemo de una sola cadena de globina puede generar un cambio en la estructura del tetrámero de hemoglobina, aumentando enormemente la afinidad de otras subunidades de globina por el oxígeno y evitando la liberación de oxígeno en tejidos periféricos. Las células que mueren por falta de oxígeno explican la letalidad potencial del CO.
Estructura Cuaternaria
La capacidad de la hemoglobina de ser el transportador de oxígeno a través de la sangre viene determinada por su estructura cuaternaria, y como es natural por la terciaria, secundaria y primaria. Pero es la estructura cuaternaria la que confiere a la hemoglobina propiedades adicionales que le permiten realizar su papel biológico. Así la hemoglobina es un proteína tetramérica (cuatro cadenas polipeptídicas), poseen dos pares de polipéptidos diferentes o unidades monoméricas (denominas a, b). Aunque semejantes en longitud global, por ejemplo en la hemoglobina A los polipéptidos α son de 141 residuos y los polipéptidos β tienen 146 residuos.
Polipéptidos α
Polipéptidos α: numerar los 141 residuos.
Polipéptidos β
Polipéptidos β: numerar los 146 residuos.
La desoxihemoglobina es una molécula más tensa (T)
Más contraida que la oxihemoglobina, a causa de que presenta 8 enlaces salinos (enlaces por fuerzas electroestáticas), mientras que la oxihemoglobina no los presenta, está más relajada (R)
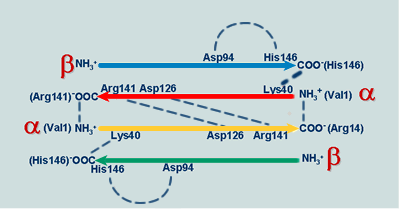
Enlaces salinos cruzados entre las diferentes subunidades de la desoxihemoglobina
Estas interacciones son perturbadas por la oxigenación
Uniones α-β: Asp94--His146--Lys40 y Asp94--His146--Lys40
Uniones α-α: Val1--Arg141 y Arg141--Val1
Asp126--Arg141 y Asp126--Arg141