Introducción a las Proteínas
Lic. Raúl Hernández M.
Contenidos:
I. IntroducciónHemoglobina
Albúmina de Suero Bovino
Citocromo C
Peso Molecular
II. Función Biológica
Función Catalítica
Función Estructural
Función de Almacenamiento
Función de Protección
Función Reguladora
Función de Transmisión del Impulso Nervioso
Función de Movimiento
Función de Transporte
I. Introducción
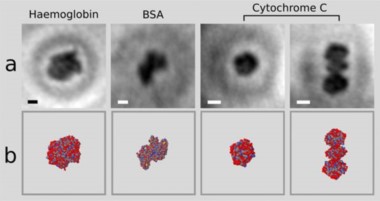
Los avances científicos que se han hecho en los últimos años en microscopía electrónica han permitido obtener fotografías de proteínas con bastante resolución, por lo que, al comparar estas imágenes con los modelos tridimensionales computacionales, hay una gran coincidencia.
Con esta técnica se han obtenido imágenes de la hemoglobina, que se encuentra en los glóbulos rojos; los citocromos, que transportan energía química en todas las células vivas; o la albúmina de suero bovino (BSA por sus siglas en inglés), muy usada en procesos bioquímicos. Las imágenes coincidieron con sus modelos moleculares, lo que sugiere que son exactas.
Hemoglobina
Albúmina de Suero Bovino
Albúmina de suero bovino
Citocromo C
Las proteínas son polímeros naturales extremadamente grandes de aminoácidos con pesos moleculares que varían de aproximadamente 6000 a varios millones de gramos. El inmenso tamaño de las proteínas se puede apreciar comparando la glucosa con la hemoglobina, una proteína relativamente pequeña. La glucosa tiene un peso molecular de 180 gramos, mientras que el peso molecular de la hemoglobina es 65,000 gramos aproximadamente. La fórmula molecular de la glucosa es C6H12O6 y el de la hemoglobina es C2952H4664O832N812S8Fe4.
Más de 10,000 residuos de aminoácidos están presentes en varias proteínas; 400-500 residuos de aminoácidos son comunes en las proteínas; las proteínas pequeñas contienen 40-100 residuos de aminoácidos.
Peso Molecular
Ejemplos de pesos moleculares y número de aminoácidos de algunas proteínas importantes:
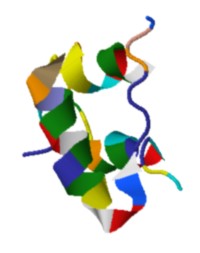
Peso molecular: 6,000 u, número de aminoácidos: 51
Puentes de hidrógeno
Alambres Esqueleto Cintas
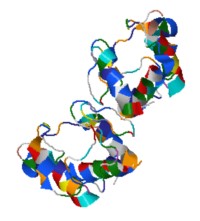
Peso molecular: 16,000 u, número de aminoácidos: 104
Puentes de hidrógeno
Alambres Esqueleto Cintas
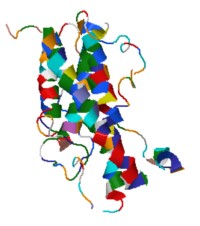
Peso molecular: 49,000 u, número de aminoácidos: 191
Puentes de hidrógeno
Alambres Esqueleto Cintas

Peso molecular: 65,000 u, número de aminoácidos: 574
Puentes de hidrógeno
Alambres Esqueleto Cintas Estructura Secundaria Cadenas

Peso molecular: 202,990.75 u, número de aminoácidos: 1804
Puentes de hidrógeno
Alambres Esqueleto Cintas Estructura Secundaria Cadenas

Peso molecular: 545,975.38 u, número de aminoácidos: 4746
Puentes de hidrógeno
Alambres Esqueleto CintasLas moléculas de proteína son demasiado grandes para pasar a través de las membranas celulares y están contenidas dentro las celdas normales donde se formaron. Sin embargo, si las células se dañan por enfermedad o trauma, el contenido de proteína puede filtrarse. Por lo tanto, cantidades excesivas persistentes de las proteínas en la orina son indicativas de células renales dañadas. Un análisis de orina de rutina por lo general incluye una prueba de proteína. Del mismo modo, un ataque al corazón puede ser confirmado por la presencia en la sangre de ciertas proteínas (enzimas) que normalmente están limitadas a las células del tejido cardíaco
Función Biológica
Las proteínas son moléculas de tremenda importancia en los seres vivos. Prácticamente todos los procesos biológicos dependen de la presencia o la actividad de este tipo de moléculas.
1. Las proteínas son esenciales en los procesos vitales.
2. Son los constituyentes fundamentales de todo protoplasma y están involucradas en la estructura de la célula y en su función.
3. Las enzimas son proteínas.
4. Muchas de las hormonas son proteínas
5. Las sustancias de cemento intercelular y el retículo que une o mantienena las células como tejidos u órganos se componen en parte de proteínas.
6. El transporte de dióxido de carbono y oxígeno se lleva a cabo por la hemoglobina y enzimas especiales en los glóbulos rojos.
7. Actúan en el control homostático del volumen de la sangre circulante y de los fluidos intersticiales a través de las proteínas plasmáticas.
8. Están involucrados en la coagulación de la sangre a través de la trombina, el fibrinógeno y otros factores proteicos.
9. Actúan como la defensa contra infecciones por medio de anticuerpos proteicos.
10. Realizan la transmisión hereditaria por nucleoproteínas del núcleo celular.
Función Catalítica (lactato deshidrogenasa)
Casi todas las reacciones que tienen lugar en los organismos vivos son catalizadas por proteínas que funcionan como enzimas. Sin estas proteínas catalíticas, las reacciones biológicas tendrían lugar demasiado lentamente para sustentar la vida. Enzima catalizada las reacciones van desde procesos relativamente simples hasta los muy complejos, como la duplicación de material hereditario en los núcleos celulares.
La lactato deshidrogenasa es una válvula de seguridad en nuestra línea de producción de energía. La mayoría de las veces, nuestras células descomponen la glucosa por completo, liberando los átomos de carbono como dióxido de carbono y los átomos de hidrógeno como agua. Esto requiere mucho oxígeno. Sin embargo, si el flujo de oxígeno no es suficiente, la tubería de producción de energía se detiene al final de la glucólisis. La lactato deshidrogenasa es la forma en que las células resuelven este problema, al menos temporalmente.
Cuando hacemos ejercicio a un ritmo normal, nuestras células obtienen suficiente oxígeno y el azúcar se descompone de manera rápida y eficiente. Sin embargo, durante los sprints u otros sobreesfuerzos, no hay suficiente oxígeno para todos. En este caso, nuestras células usan la glucólisis como su principal fuente de energía. Como parte de la glucólisis, el hidrógeno de la glucosa se coloca en NAD+ para formar NADH. Normalmente, estos átomos de hidrógeno se transfieren a oxígeno para formar agua. Si no hay oxígeno disponible, el NADH se acumula y no hay suficiente NAD+ para continuar usando la glucólisis para producir ATP. Ahí es donde interviene la lactato deshidrogenasa: combina piruvato y NADH, produciendo ácido láctico y NAD+. El NAD+ puede luego reciclarse para hacer otra ronda de glucólisis, produciendo rápidamente más energía para el sprint. Sin embargo, el ácido láctico se acumula y en cuestión de un minuto más o menos, debe detenerse y dejar que su cuerpo se recupere. Cuando recuperas la respiración, tu cuerpo convierte el ácido láctico en piruvato, donde entra en tu flujo normal de producción de energía aeróbica.
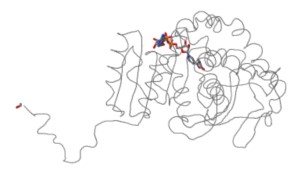
Puentes de hidrógeno
Alambres Esqueleto Cintas Pelotas Estructura Secundaria Cadenas Grupos prostéticosÁcido Pirúvico (sitio activo)
NADH (sitio activo)
Función Estructural (queratina)
El material estructural principal para las plantas es la celulosa. En el reino animal, otros materiales estructurales distintos de los inorgánicos, que son constituyentes del esqueleto, están compuestos de proteína. El colágeno, una proteína similar a la fibra, es responsable de la resistencia mecánica de la piel y el hueso. Otro ejemplo es la queratina, que es constituyente del cabello, la piel y las uñas.
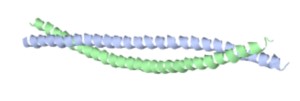
Puentes de hidrógeno
Alambres Esqueleto Cintas Pelotas Estructura Secundaria CadenasFunción de Almacenamiento (ferritina)
Algunas proteínas proporcionan una forma de almacenar pequeñas moléculas o iones. La ovoalbúmina, por ejemplo, es una proteína que almacena aminoácidos que utilizan los embriones ayudando al desarrollo de los huevos de los pájaros. La caseína, una proteína láctea y la gliadina (almacena aminoákcidos), en las semillas de trigo, también son formas almacenadas de proteína destinadas a nutrir animales y plantas, respectivamente. la ferritina, se encuentra en todas las células del cuerpo, se une a los iones de hierro y forma un complejo de almacenamiento en humanos y otros animales.
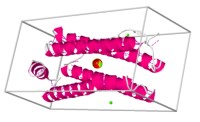
Puentes de hidrógeno
Alambres Esqueleto Cintas Pelotas Estructura Secundaria Cadenas Grupos prostéticosFerritina (sitio activo con Fe+3)
Ferritina (sitio activo con Fe+3)
Función Protectora (fibrinógeno)
Los anticuerpos son proteínas tremendamente importantes que protegen el cuerpo de la enfermedad. Estas proteínas altamente específicas se combinan con y ayudan a destruir virus, bacterias y otras sustancias extrañas que entran en la sangre o tejido de el cuerpo. La coagulación de la sangre, otro proceso de protección, se lleva a cabo por las proteínas trombina y fibrinógeno. Sin este proceso, incluso pequeñas heridas darían lugar a sangrado que amenaza la vida. El fibrinógeno es una proteína soluble del plasma sanguíneo precursor de la fibrina, su longitud es de 46nm, su peso 340 kDa. Es responsable de la formación de los coágulos de sangre; cuando se produce una herida se desencadenala transformación del fibrinógeno en fibrina gracias a la actividad de plaquetas. Todas las cadenas de fibrinógeno tienen zonas de carbohidratos, el principal es el ácido siálico cuyo exceso dificulta la polimerización de la fibrina y genera coágulos débiles.

Puentes de hidrógeno
Alambres Esqueleto Cintas Pelotas Estructura Secundaria Cadenas Grupos prostéticosÁcido Siálico (sitio activo)
Función Reguladora (hormona de crecimiento)
Numerosos procesos corporales están regulados por hormonas, muchas de las cuales son proteínas. Ejemplos son la hormona del crecimiento, que regula el crecimiento de animales jóvenes, y tirotropina, que estimula la actividad de la tiroides glándula.

Puentes de hidrógeno
Alambres Esqueleto Cintas Pelotas Estructura Secundaria Cadenas Grupos prostéticosFunción de Transmisión del Impulso Nervioso (rodopsina)
Algunas proteínas se comportan como receptores de pequeñas moléculas que pasan entre huecos (sinapsis) que separan las células nerviosas. De esta manera, transmiten impulsos nerviosos de un nervio a otro. Rodopsina, una proteína que se encuentra en las células de barra de la retina del ojo, funciona de esta manera en el proceso de visión.
Nuestros ojos son cámaras biológicas, completas con una lente deformable para enfocar la luz, un iris ajustable para controlar la exposición y una retina que actúa como un sensor digital para grabar la imagen enfocada. Está lleno de refinamientos increíbles, como una capa de células negras oscuras detrás de la retina que reducen la reflexión y mantienen la imagen nítida.
La rodopsina juega el papel central en esta cámara: es la molécula que detecta la luz. Está compuesto por una pequeña molécula de retinal sensible a la luz, unida dentro de la proteína opsina. Cuando la retina absorbe un fotón, cambia de forma, con un enlace volteando desde una conformación doblada (cis) a una conformación extendida (trans). Esta pequeña señal molecular es capturada por la proteína opsina circundante y se utiliza para lanzar una señal a través de una red de señalización de proteína G, que amplifica la señal y, en última instancia, conduce a una señal nerviosa para el cerebro.
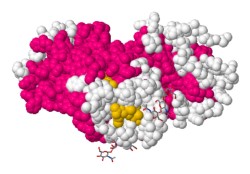
Puentes de hidrógeno
Alambres Esqueleto Cintas Pelotas Estructura Secundaria Cadenas Grupos prostéticosRetinal (sitio activo)
Función de Transmisión de Movimiento (actina)
Cada vez que subimos escaleras, presionamos un botón, o pestañamos, usamos músculos que tienen proteínas como sus principales componentes. Las proteínas actina y la miosina son particularmente importantes en procesos que implican movimiento. Ellas son proteínas constituídas por filamentos largos que se deslizan una sobre la otra durante la contracción muscular.
La actina tiene una rara combinación de fuerza y sensibilidad. Los filamentos de actina se utilizan en muchas de las tareas estructurales más extenuantes, pero al mismo tiempo, los filamentos de actina se desmontan fácil y continuamente. Una de las principales características de la actina es su carácter dinámico. Los filamentos de actina se construyen continuamente y se descomponen a medida que las necesidades de la célula cambian de momento a momento. En casos especiales, como la actina muscular o los haces de actina en las microvellosidades, una colección de proteínas especializadas que se unen a la actina estabiliza el filamento, formando una estructura más permanente. Pero la mayor parte de la actina en las células típicas está en constante flujo, formando filamentos constantemente y descomponiéndose para cada nueva tarea.
Los grandes conjuntos de proteínas helicoidales, como los filamentos de actina, son notoriamente difíciles de estudiar mediante cristalografía, porque los filamentos no forman cristales perfectos. Las estructuras de la actina en el PDB tienen algo ligado a ellas, bloqueando la formación de un filamento, por lo que las estructuras contienen una sola molécula de actina, no un filamento de actina completo.
En este modelo se muestra en color celeste, una enzima que corta el ADN que se unió a la actina. En amarillo, la actina con una molécula de ATP en el sitio activo.
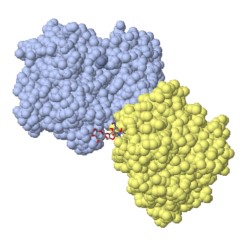
Puentes de hidrógeno
Alambres Esqueleto Cintas Pelotas Estructura Secundaria Grupos prostéticosATP en el sitio activo de la actina
Función de Transporte (albúmina sérica)
Numerosas moléculaspequeñas y también iones son transportados de manera efectiva a través del cuerpo solo después de unirse a las proteínas. Por ejemplo, los ácidos grasos son transportados entre el tejido graso (adiposo) y otros tejidos u órganos por la albúmina sérica, una proteína sanguínea. La hemoglobina, un ejemplo bien conocido, transporta oxígeno de los pulmones a otras tejidos del cuerpo, y la transferrina es un portador de hierro en el plasma sanguíneo.
La actina tiene una rara combinación de fuerza y sensibilidad. Los filamentos de actina se utilizan en muchas de las tareas estructurales más extenuantes, pero al mismo tiempo, los filamentos de actina se desmontan fácil y continuamente. Una de las principales características de la actina es su carácter dinámico. Los filamentos de actina se construyen continuamente y se descomponen a medida que las necesidades de la célula cambian de momento a momento. En casos especiales, como la actina muscular o los haces de actina en las microvellosidades, una colección de proteínas especializadas que se unen a la actina estabiliza el filamento, formando una estructura más permanente. Pero la mayor parte de la actina en las células típicas está en constante flujo, formando filamentos constantemente y descomponiéndose para cada nueva tarea.
Los grandes conjuntos de proteínas helicoidales, como los filamentos de actina, son notoriamente difíciles de estudiar mediante cristalografía, porque los filamentos no forman cristales perfectos. Las estructuras de la actina en el PDB tienen algo ligado a ellas, bloqueando la formación de un filamento, por lo que las estructuras contienen una sola molécula de actina, no un filamento de actina completo.
En este modelo se muestra en color celeste, una enzima que corta el ADN que se unió a la actina. En amarillo, la actina con una molécula de ATP en el sitio activo.

Puentes de hidrógeno
Alambres Esqueleto Cintas Pelotas Estructura Secundaria Cadenas Grupos prostéticosÁcido Estearico (sitio activo)