Estructura Primaria y Secundaria de las Proteínas
Lic. Raúl Hernández M.
Contenidos:
1. IntroducciónEnlace Péptido
2. Estructura Primaria
Insulina
Mutaciones
Vasopresina
Oxitocina
3. Estructura Secundaria
Plegamiento
Gancho
Diedros
Hélice α
Hélice 310
Hoja Plegada β
Giros
Introducción
El nombre de proteína, acuñado hace más de 100 años, se deriva del griego Proteios, que significa "de primera importancia", término muy apropiado para estas sustancias que son las más importantes de todos los compuestos biológicos.
Como era de esperar, las estructuras de moléculas extremadamente grandes, como las proteínas, son mucho más complejas que la de los de compuestos orgánicos simples. Muchas moléculas de proteínas consisten en una cadena de aminoácidos retorcidos y plegados en una estructura completa tridimensional. Esta estructura compleja imparte características únicas a las proteínas que les permiten funcionar de diversas maneras en los sistemas biológicos. Para entender de mejor forma la función de las proteínas, debemos ver cuatro niveles de organización en su estructura. Estos niveles son referidos como primario, secundario, terciario y cuaternario.
Enlace Peptídico
Dos aminoácidos pueden unirse covalentemente formando un enlace amida sustituido, que se denomina enlace peptídico:
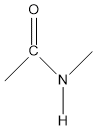
El enlace peptídico (-CO-NH-) se representa normalmente como un enlace sencillo. Sin embargo, posee una serie de características que lo aproximan más a un doble enlace. Los átomos de C, N y O que participan en el enlace amida presentan una hibridación sp2, de forma que los 5 orbitales enlazantes de tipo sigma adoptan una disposición triangular plana como se puede observar en el dipéptido formado por dos moléculas de adenina.
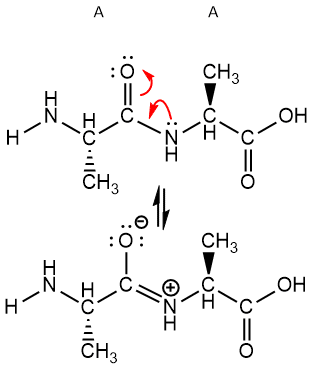
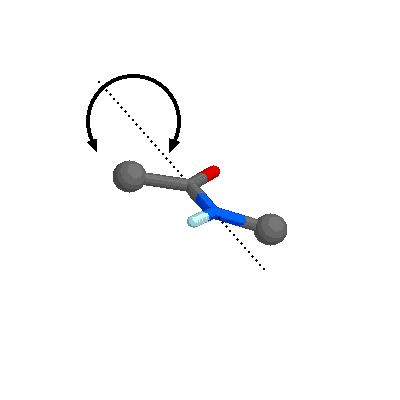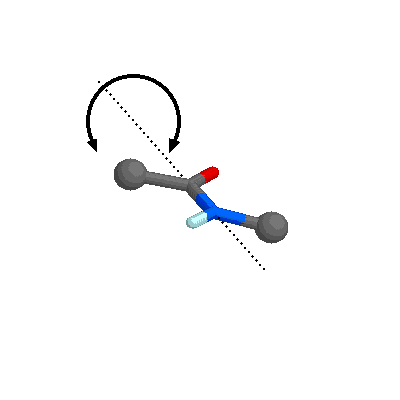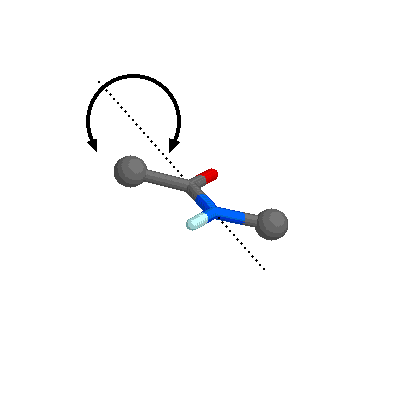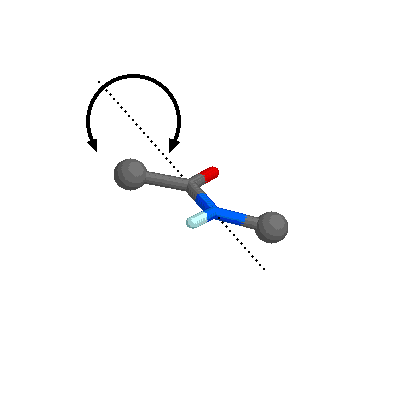
Resonancia del enlace peptídico.
El enlace peptídico se forma porque reacciona el grupo carboxilo de un aminoácido con un grupo amino en posición α del otro aminoácido, perdiéndose una molécula de agua.
Miremos el ejemplo de la reacción entre la glicina con serina para formar el dipéptido glicil-serina.
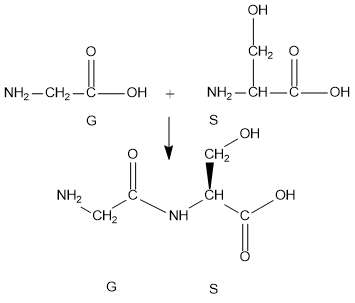
→
Los enlaces de amida pueden formarse a partir de diversos ácidos y aminas, pero cuando un enlace amida, —CONH—, une dos aminoácidos, se tiene un enlace peptídico.
Estructura Primaria
Cada proteína, ya sea hemoglobina, queratina o insulina, tiene una columna vertebral similar de carbono y átomos de nitrógeno unidos por enlaces peptídicos:
La diferencia en proteínas es la variación en la longitud de la columna vertebral y la secuencia de las cadenas laterales (grupos R) que están unidas a la red troncal. El orden en que los residuos de aminoácidos se unen en una proteína se llama la estructura primaria
Cada proteína diferente en un organismo biológico tiene una secuencia única de residuos de aminoácidos. Esta secuencia es la que hace que una cadena de proteína se doble y cuve en una forma distintiva, que a su vez, permita que funcione correctamente. Una proteína que pierde esta característica o conformación tridimensional, deja de funcionar como tal.
Péptido
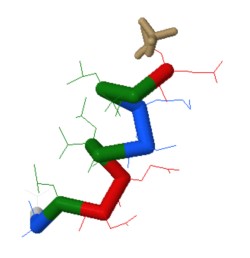
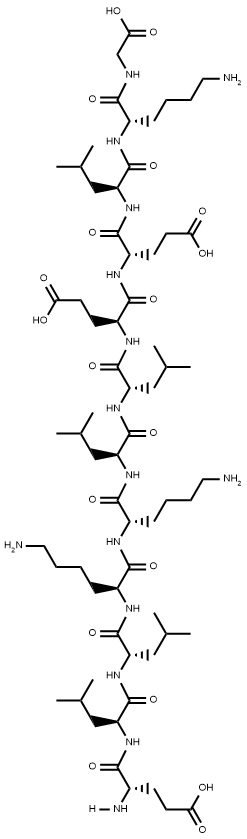
Esta molécula es un péptido de doce aminoácidos: ELLKKLLEELKG.
Puentes de hidrógeno
Esqueleto Cintas Estructura Secundaria Cadenas Grupos prostéticos
Grupos prostéticos (acercamiento)
Insulina
Los bioquímicos han ideado técnicas para encontrar el orden en que los residuos son Unidos entre sí en cadenas de proteínas. Algunas de las proteínas cuyas estructuras primarias son conocidas se enumeran a continuación:

51 aminoácidos
Puentes de hidrógeno
Esqueleto Cintas Estructura Secundaria Cadenas
Mutaciones
Las mutaciones genéticas pueden alterar la secuencia de aminoácidos de la cadena polipeptídica. Estas modificaciones pueden producir:
cambios conservadores: en los cuales la naturaleza de la cadena lateral es mantenida (Ej: si es reemplazado un residuo de Asparagina por uno de Glutamina); en este caso, los cambios en la estructura y función proteica no son tan significativos.
cambios no conservadores: donde la mutación reemplaza el aminoácido por otro de propiedades diferentes (Ej: se reemplaza un residuo de Arginina por otro de Prolina). Este último tipo de cambios en la cadena peptídica puede llegar a alterar la función de la proteína y si ocurren en células sexuales pueden llegar a perpetuarse en futuras generaciones, siendo un factor muy importante en los procesos evolutivos.
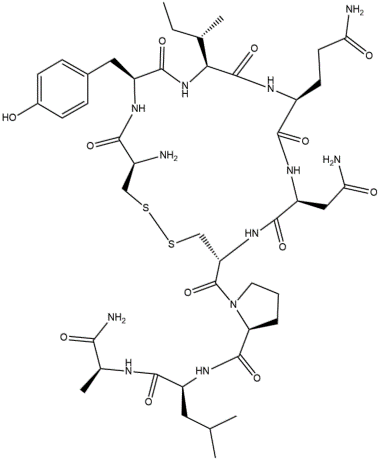
La identidad y secuencia de los residuos de aminoácidos en péptidos y proteínas es extremadamente importante para la función fisiológica adecuada. Dos ejemplos bien conocidos son vasopresina y oxitocina, que son hormonas liberadas por la glándula pituitaria. Cada hormona es un nonapéptido (nueve residuos de aminoácidos) con seis de los residuos retenidos en forma de un bucle por un enlace disulfuro.
Las diferencias están en los aminoácido 3 y 8. Los grupos carboxilato normales de los restos C-terminales (Gly) han sido reemplazado por grupos de amida.
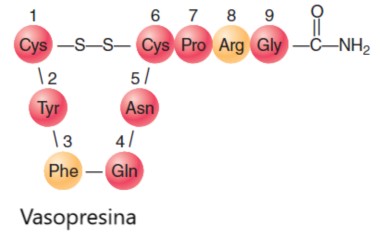
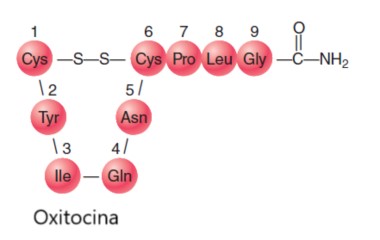
Vasopresina
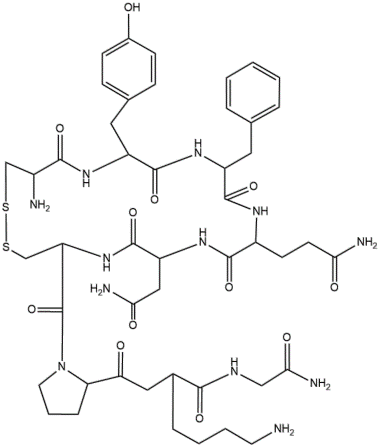
Oxitocina
Puentes de hidrógeno
Estructura Secundaria
Es el modo de disposición de la secuencia de aminoácidos (su estructura primaria). Es decir, la cadena polipeptídica se puede enrollar o disponer siguiendo determinados patrones, por ejemplo, uno de los arregos más comunes e importantes de la estructura secundaria es la hélice α. Otra forma es la llamada hoja plegada β.
Se distinguen 4 tipos principales de motivos de estructura secundaria en proteínas: hélice α, hélice 310, lámina u hoja plegada β, giros. Para que una proteína pueda formar la estructura secundaria, es necesario que se de un plegamiento del péptido o polipépido para que se pueda lograr una estabilización por formación de puentes de hidrógeno.
Plegamiento
El plegamiento de proteínas es el proceso mediante el cual una estructura de proteínas asume su forma o conformación funcional. Todas las moléculas de proteína son cadenas heterogéneas no ramificadas de aminoácidos. Cuando se doblan y enrollan adquieren una forma tridimensional específica, es en esta conformación que realizan su función biológica.
Plegamiento
Formación de un gancho
Formación de un gancho
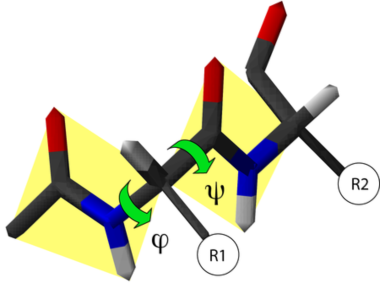
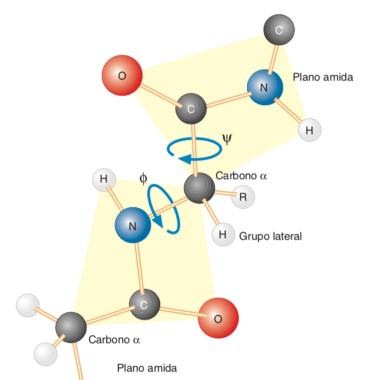
Ángulos Diedros
El gráfico de Ramachandran fue creado por el bioquímico hindú Gopalasamudram Narayana Ramachandran junto con Viswanathan Sasisekharan. En él se pueden visualizar todas las combinaciones posibles de ángulos diédricos Ψ (psi) contra Φ (phi) en los aminoácidos de un polipéptido, y que contribuyen a la conformación de la estructura de las proteínas. Por medio de este diagrama se puede calcular la estructura secundaria del péptido, porque existen combinaciones angulares propias para cada estructura (hélice α y y hoja plegada β). La conformación de los péptidos se define mediante la asignación de valores para cada par de esquinas Φi, Ψi para cada aminoácido. En el segundo cuadrante se hallan las combinaciones de la hoja β, en el tercer cuadrante se hallan la hélice α derecha y los giros o bucles (loops); en el primer cuadrante las combinaciones de la hélice α izquierda.
No todos los pares de ángulos son realmente posibles dentro de las estructuras de los péptidos. Esto se debe a los efectos estéricos entre los residuos (cadenas laterales) de los aminoácidos.
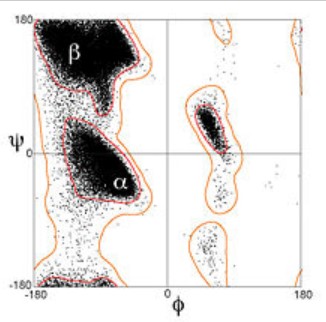
En el caso de la glicina, las zonas de posible conformación de la tabla con una simetría central, y son mucho más amplias que las de los demás aminoácidos, debido a que tiene solo H como cadena lateral.
Otro caso especial es la prolina, único aminoácido capaz de tener enlaces cis y trans.
Esta característica planar del enlace peptídico permite dos conformaciones posibles con respecto a las conformaciones de los carbonos α, trans y cis. Cuando los dos carbonos α están en lados opuestos del enlace peptídico, se dice que los grupos R están en conformación trans. Por el contrario, cuando los dos carbonos α están en el mismo lado del enlace peptídico, se dice que los grupos R están en conformación cis. La conformación trans está muy favorecida debido al impedimento estérico encontrado en la conformación cis.
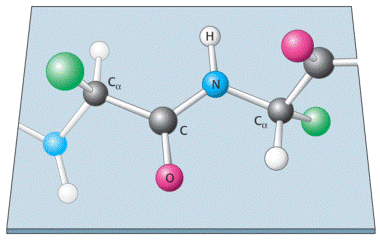
Conformación Trans
Conformación Cis
Una excepción la constituye los enlaces peptídicos en los que está implicado el nitrógeno imídico de la prolina. En estos enlaces la conformación cis- sólo presenta pequeños impedimentos estéricos respecto a la trans-. Alrededor del 6% de los residuos de prolina analizados por cristalografía de rayos X se encuentran en conformación cis-.
Geometría Cis
Hélice α
La hélice α derecha es la más abundante en las proteínas globulares. Su conformación es muy estable y corresponde a una posición central de una de las regiones permitidas del mapa Φ = -57º y Ψ = -47º. En este tipo de estructura el esqueleto peptídico se encuentra enrollado de forma compacta alrededor del eje longitudinal de la molécula, y las cadenas laterales.
El esqueleto peptídico (el eje de la hélice) en amarillo y los Cα en negro. Observar cómo las cadenas laterales se dirigen hacia el exterior.
La hélice α se encuentra estabilizada:
Puentes de hidrógeno entre el grupo carbonilo y el grupo amida del enlace peptídico de los restos (i) e (i+4), respectivamente. En gris oscuro se representan los C.
Los puentes de hidrógeno de la hélice α formada ente el aminoácido (i) e (i+4).
Las distancias de enlace de los puentes de hidrógeno entre el N(i) y el O(i+4).
Establecimiento de interacciones de Van der Waals entre los átomos a través de su eje, ya que el radio de la hélice es 2.3 Å.
La hélice es dextrógira (avanza en el sentido de las agujas del reloj vista desde arriba).
Cada residuo gira 100º con respecto al anterior y se desplaza 0.15 nm con respecto al residuo anterior.
Finalmente, son necesarios 3.6 residuos y 0.54 nm, para dar una vuelta completa de la hélice.
Hélice 310
Se denomina con este nombre porque contiene 3 restos por vuelta de hélice y 10 átomos encerrados en el anillo. Corresponde a los ángulos Φ = -49º y Ψ = -26º. Al igual que la hélice α las cadenas laterales de los aminoácidos sobresalen hacia el exterior del esqueleto helicoidal.
Su estabilidad se debe a la formación de puentes de hidrógeno entre el grupo carbonilo y el grupo amida del enlace peptídico de los restos i e i+3, respectivamente. Son menos estables que las hélices α.
Presentan un empaquetamiento de las cadenas laterales (en la misma vertical) menos favorable que el empaquetamiento alternado que se observa en las hélices α.
Además los puentes de hidrógeno en este tipo de estructura secundaria no se encuentran perfectamente alineados, con lo que la fuerza del enlace es menor.
La hélice es dextrógira (avanza en el sentido de las agujas del reloj vista desde arriba).
Cada residuo gira 120º con respecto al anterior y se desplaza 0,25 nm con respecto al residuo anterior.
Son necesarios 3 residuos y 0,6 nm, para dar una vuelta completa.
Hoja Plegada β
Modelo de la región cristalina, con secuencia [Gly-Ala-]n de la seda
Tres hebras beta, cada una de una lámina (los enlaces de H intercatenarios que forman cada lámina beta van de adelante hacia atrás).
La estructura secundaria del tipo lámina β u hoja extendida dispone su esqueleto peptídico extendido en "zig-zag".
Este tipo de estructura permite la asociación de dos o más cadenas dispuestas una al lado de la otra. De esta forma logran su estabilidad mediante puentes de hidrógeno entre los grupos amida y carbonilo del enlace peptídico entre cadenas adyacentes. Cada cadena constituye un grupo lineal, es decir todos los ángulos Φ y Ψ son idénticos.
Esta estructura se representa con una flecha que indica la dirección de la cadena, y el sentido desde el extremo N- hasta el C-terminal.
Hay 2 tipos de láminas β en proteínas:
Lámina β paralela cuando el sentido (N-terminal a C-terminal) es el mismo en ambas cadenas.
Lámina β antiparalela cuando el sentido (N-terminal a C-terminal) es diferente en ambas cadenas.
Giros
La conformación espacial de las proteínas requiere cambios en el sentido de progresión de su estructura secundaria con objeto de alcanzar el grado de empaquetamiento característico de su estructura nativa. Estos cambios de sentido se logran con los acodamientos β, que se realizan mediante la formación de un puente de hidrógeno entre el grupo carbonilo del aminoácido i y el grupo amida del aminoácido i+3.
Φ2 = -60º, Ψ2 = -30º, Φ3 = -90º, Ψ3 = 0º
Φ2 = -60º, Ψ2 = -120º, Φ3 = -90º, Ψ3 = 0º
Cada uno de estos tipos de giro permite un cambio brusco de la dirección de la cadena polipeptídica. En el tipo II el residuo 3 suele ser la glicina, ya que un grupo lateral voluminoso presentaría conflictos con el oxígeno carbonílico del residuo 2.
La prolina y la glicina (color verde) se encuentran frecuentemente en los giros o acodamientos β. La prolina es un iminoácido por lo que puede formar enlaces de tipo cis. La glicina es frecuente debido a su pequeño tamaño. Los acodamientos β promueven la formación de laminas β antiparalelas
Los giros se clasifican como un tipo de estructura secundaria, pero a diferencia de las hélices y láminas que tienen estructuras ordenadas y repetitivas, los giros solo tienen estructuras ordenadas, pero como hélices y láminas se pueden clasificar por los valores de los ángulos de torsión de las Cα.
Todos los giros β contienen cuatro residuos y se dividen en clases basadas en el rango de sus valores Φ y Ψ para el segundo y tercer residuo. La mayoría de las clases tienen un enlace de hidrógeno entre los átomos de enlace inverso de los residuos uno (i) y cuatro (i + 3), y esta atracción es la fuerza principal que mantiene la conformación del doblez de la cadena, pero en varias clases una prolina (Pro) en la tercera la posición (i + 2) tiene la configuración cis que produce una conformación que no puede formar un enlace de hidrógeno.
Siete giros β se muestran como trazas azules en la miohemeritrina. Solo hay cinco segmentos azules porque, en dos casos, un giro β sigue a otro. Solo cinco de los giros contienen enlaces de hidrógeno que se muestran en magenta.
Ejemplos de cuatro de las nueve clases de giros β se muestran a continuación con dos ejemplos de cada una de las cuatro clases. Los giros se cortaron a partir de miohemeritrina (2mhr.pdb) o del dominio 2 de la cadena de glucógeno fosforilasa A (1abb.pdb). Compare las formas de los giros y observe las diferencias en los valores phi (φ) y psi (ψ) del segundo y tercer residuo.
Residuo 2: φ = -66°, ψ = -19°; Residuo 3: φ = -91°, ψ = -1°
Residuo 2: φ = -70°, ψ = -25°; Residuo 3: φ = -109°, ψ = +29°
Residuo 2: φ = -56°, ψ = +126°; Residuo 3: φ = +78°, ψ = +1°
Residuo 2: φ = -53°, ψ = +131°; Residuo 3: φ = +78°, ψ = -10°
Residuo 2: φ = +56°, ψ = -117°; Residuo 3: φ = -125°, ψ = +19°
Residuo 2: φ = +47°, ψ = -122°; Residuo 3: φ = -94°, ψ = +2°
Residuo 2: φ = -135°, ψ = +112°; Residuo 3: φ = -63°, ψ = +163°
Residuo 2: φ = -89°, ψ = +142°; Residuo 3: φ = -76°, ψ = +135°