Estructura Terciaria de las Proteínas
Lic. Raúl Hernández M.
Contenidos:
1. IntroducciónQuimotripsina
2. Enlace por Puente Disulfuro
3. Enlace Salinos
4. Puentes de Hidrógeno
5. Interacciones hidrofóbicas
6. Fuerzas de Van der Waals
Introducción
Muchos tipos de fuerzas e interacciones desempeñan un papel importante para mantener una proteína en su conformación correcta, nativa. Algunas de estas fuerzas son covalentes, pero muchas no son. La estructura primaria de una proteína: el orden de los aminoácidos en el cadena polipeptídica: depende de la formación de enlaces peptídicos, que son covalentes. Los niveles de estructura de orden superior, como la conformación de la red troncal (estructura secundaria) y las posiciones de todos los átomos en la proteína (estructura terciaria), depende de interacciones no covalentes. Si la proteína consiste de varias subunidades, la interacción de las subunidades (estructura cuaternaria) también depende de las interacciones no covalentes. Las fuerzas de estabilización no covalente contribuyen a la estructura más estable para una proteína determinada, la que tiene la energía más baja.
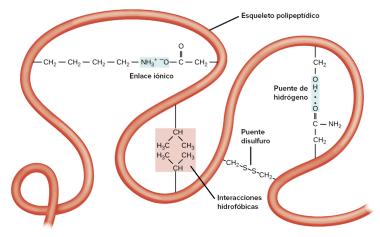
La estructura de las proteínas esta estabilizada entonces por diferentes tipos de enlaces, como enlaces covalentes (enlace peptídico, enlace por puentes disulfuro), enlaces por puentes de hidrógeno (interacciones dipolo-dipolo), interacciones hidrofóbicas, enlaces salinos (interacciones electrostáticas) o las fuerzas de los contactos de Van der Waals. Todos estos tipos de enlaces juegan un importante papel en la estabilización de la estructura tridimensional de las proteínas. La fuerza de atracción de los diferentes enlaces que intervienen en la estabilización de las proteínas se expresa en kcal/mol, y corresponde a la energía liberada al formar el enlace, o la energía que debe suministrarse para romper el enlace que es:
| Tipo de Enlace | Fuerza (kcal/mol) |
|---|---|
| Covalente | -50 a –100 |
| Iónico o Salino | -1 a –80 |
| Puente de Hidrógeno | -3 a –6 |
| Van der Waals | -0,5 a –1 |
| Hidrofóbico | -0,5 a –3 |
Un ejemplo de un péptido de 12 aminoácidos pertenecientes a la estructura de la quimotripsina (desde la glicina193 a la asparragina204), servirá para ilustrar los diferente tipos de enlaces que se dan para estabilizar la estructura de las proteínas. La quimotripsina está formada por cuatro cadenas polipeptídicas.
Quimotripsina
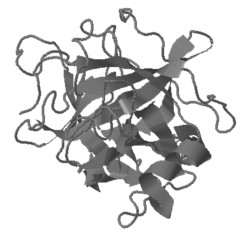
Quimotripsina
Cadena A
Cadena B
Cadena C
Cadena D
El esqueleto polipeptídico se representa en color azul, mientras que las cadenas laterales de los aminoácidos se representan con los colores típicos.
Enlaces por Puente Disulfuro
Este tipo de enlaces se establece al oxidarse dos cisteínas para formar una cistina, unión de los dos azufres. Este tipo de uniones se conocen con el nombre de puentes disulfuro. -CH2-S-S-CH2-. Por ejemplo el puente disulfuro entre la Cys201 y la Cys136.
Enlaces Salinos
Los aminoácidos básicos y ácidos de las proteínas presentan a pHs fisiológicos carga. Al poderse encontrar en el esqueleto polipeptídico aminoácidos ácidos (Glu y Asp) que presentan carga negativa; y aminoácidos básicos (His, Lys y Arg) que presentan carga positiva; hay distintas regiones de las proteínas con carga opuesta que se atraen por fuerzas electrostáticas, interacciones que se conoce Los aminoácidos que presentan carga en su cadena lateral se suelen localizar más en la parte exterior de la proteína, que en el interior de la misma, en esta localización se encuentran mayoritariamente los aminoácidos hidrofóbicos. Aunque es raro encontrar aminoácidos cargados en el interior de la proteína, si están, juegan un papel importante ya que la distancia y fuerza de este tipo de enlace se aproxima a los valores del enlace covalente (2,8 Å). En el modelo propuesto como ejemplo, el grupo ácido de la cadena lateral del Asp194 interacciona con el grupo amino terminal de la cadena B, corresponiente a una Ile16.
Los grupos cargados normalmente se encuentran en la superficie de la proteína, y determinan el correcto plegamiento de la proteína al poder interaccionar con el agua de solvatación. Las moléculas de agua interaccionan con las cargas de las cadenas laterales (o grupo amino y carboxilo terminal). Son ejemplos de este tipo de interacción las Lys202 y Lys203 con las moléculas de agua de solvatación.
Puentes de Hidrógeno
En la estructura de las proteínas hay diferentes tipos de enlaces por puentes de hidrógeno, dependiendo de los átomos que intervienen en el mismo.
Las diferentes posibilidades entre átomos son las siguientes:
- 1. átomos en las cadenas laterales de aminoácidos y agua enla superficie de la proteína.
- 2. átomos en las cadenas laterales de aminoácidos y átomos de la cadena peptídica de la proteína.
- 3. átomos de la cadena peptídica y moléculas de agua en la superficie de la proteína.
- 4. átomos de la cadena peptídica de dos aminoácidos diferente.
Las cadenas laterales de dos aminoácidos de la cadena polipeptídica
La Ser195 en el modelo peptídico está situada de tal manera que interacciona con la His57 a través de un puente de hidrógeno, el grupo -OH de la Ser comparte el hidrógeno con un N de la cadena lateral del anillo de la His57.
Los átomos de la cadena lateral de los aminoácidos y las moléculas de agua de solvatación
La Asn204 contiene en la cadena lateral un grupo carboxilo C=O, grupo que puede formar un puente de hidrógeno con el agua de disolución en la superficie de la proteína.
Los átomos de la cadena lateral de los aminoácidos y los átomos del esqueleto polipeptídico
La Gly193 forma un enlace de hidrógeno a través del grupo carboxilo con un grupo -NH de la cadena lateral de la His40.
Los átomos del esqueleto polipeptídico
La mayoría de los enlaces por puente de hidrogeno están formados por el esqueleto polipeptídico de la proteína entre los grupos amino (NH) y carbonilo (C=O), que forman las hélices α o las lámina ß. En el modelo polipeptídico (residuos 193-204) es una lámina que está formando puentes de hidrógeno con un lámina antiparalela (residuos 205-214). Así se establecen dos puentes de hidrógeno entre los átomos de la cadena polipeptídica en la Leu199 y la Gly211.
Interacciones hidrofóbicas
Las interacciones hidrofóbicas se dan entre las cadenas laterales de los aminoácidos hidrofóbico, estos aminoácidos suelen disponerse en el interior de la proteína, evitando de esta manera las interacciones con el agua. Este tipo de fuerzas hidrofóbicas intervienen en el correcto plegamiento de la proteína. Las uniones hidrofóbicas suelen darse en el interior, corazón hidrofóbico de la proteína, donde la mayoría de cadenas laterales puede asociarse estrechamente y se encuentran protegidas de las interacciones con el disolvente. Así la Pro198 y la Val200 son dos de los seis aminoácidos hidrofóbicos del modelo polipeptídico. Estos dos aminoácidos se asociación de manera estrecha con las cadenas hidrocarbonadas de Leu209, Val121 y Trp207. Este tipo de interacciones ayudan a mantener la estructura tridimensional de las proteína.
Aunque no todos los aminoácidos hidrofóbicos se encuentran en el interior de las proteínas, cuando las cadena lateral hidrofóbicas están expuestas a las moléculas polares del agua usualmente involucran un enlace hidrofóbico externo. Podemos observar la unión hidrofóbica entre la Pro24 y Phe71.
Fuerzas de Van der Waals
Las fuerzas de Van der Waals, son atracciones eléctricas débiles entre diferentes átomos. Estas fuerzas son el resultado de las fuerzas atractivas y repulsivas que se establecen al acercarse los átomos, de manera que existe una distancia en que la atracción es máxima. Esta distancia se encuentra en lo que se conoce con el nombre de radios de Van der Waals. Estas fuerzas se deben a que cada átomo posee una nube electrónica que puede fluctuar, creando de esta manera dipolos temporales. El dipolo transitorio en un enlace puede inducir un dipolo complementario en otro enlace, provocando que dos átomos de los diferentes enlaces se mantengan juntos. Estos dipolos transitorios provocan una atracción electrostática débil: las fuerzas de Van der Waals.
Las interacciones hidrofóbicas y las fuerzas de Van der Waals son causadas por diferentes interacciones. Las interacciones hidrofóbicas ocurren cuando los aminoácidos no polares (hidrofóbicos) se asocian entre sí y se agrupan para esconderse del agua, generalmente en el interior de una proteína. Las fuerzas de Van der Waals se pueden describir como "atracciones débiles entre los átomos debido a nubes de electrones opuestamente polarizadas". Son débiles y transitorias, pero muchas de ellas juntas pueden estabilizarse. Las interacciones hidrofóbicas también son débiles, pero más fuertes que las fuerzas de Van der Waals.
Los puntos alrededor de los átomos representan el radio de Van der Waals. Estas atracciones de Van der Waals, aunque transitorias y débiles son un componente importante en la estructura de las proteínas porque su número es importante. La mayoría de los átomos de una proteína están empaquetados lo suficientemente próximos unos de otros para involucrar estas fuerzas transitorias.