Introducción a la
Estructura de Carbohidratos (monosacáridos)
Lic. Raúl Hernández M.
Contenidos:
I. TriosasII. Enantiómeros
III. Pentosas
IV. Hexosas
V. Epímeros
VI. Diastereoisómeros
I. Triosas
Proyección de Fischer.
Es una representación bidimensional de una molécula tridimensional. Pone el grupo más oxidado en la parte superior y utiliza líneas horizontales en lugar de cuñas para los enlaces que se proyectan hacia fuera del papel. También utiliza líneas verticales en lugar de guiones para los enlaces que se proyectan hacia atrás.


1. Esqueleto de carbonos en vertical.
2. Grupo carbonilo en la parte superior, con lo que la numeración de los carbonos aumenta hacia abajo.
3. Alrededor de cada carbono quiral, los enlaces con los carbonos vecinos deben ir hacia atrás (y en vertical), mientras que
4. los enlaces con los sustituyentes (-H y -OH) deben salir hacia delante (y en horizontal). Estas representaciones son formatos equivalentes:
Nomenclatura D-, L- de los isómeros:
Una vez colocada de este modo la estructura, si el grupo -OH del último carbono quiral se dispone hacia la derecha, el monosacárido se nombra como D-; si va hacia la izquierda, se trata de un miembro de la serie L-.
Por extensión, se utiliza un convenio similar para definir las series D- y L- de los aminoácidos, en los que el grupo amino toma el lugar del hidroxilo y el carboxilo el del carbonilo.
Hermann Emil Fischer (18521919); premio Nobel de Química en 1902.

Estereoisomería de las Triosas.
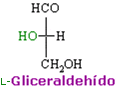
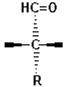
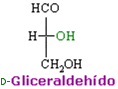
L- y D-gliceraldehído son enantiómeros.
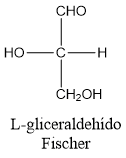
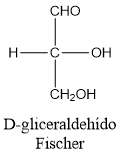
L-gliceraldehído.
D-gliceraldehído.
Por tanto, el gliceraldehído tiene dos estereoisómeros del tipo de los enantiómeros, que son imágenes especulares, no superponibles, uno del otro.
Dihidroxicetona
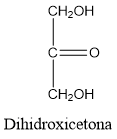
Las triosas son los monosacáridos más sencillos. Los dos tautómeros (isómeros estructurales que difieren en la disposición de sus átomos de hidrógeno y los dobles enlaces) de triosa ilustran la diferencia que existe entre los monosacáridos de aldosa y cetosa, también llamados de forma más descriptiva aldotriosa y cetotriosa, respectivamente. La numeración de los carbonos se inicia en todas las aldosas por el aldehido, y en las cetosas por el carbono terminal más próximo al grupo cetona. (Dado que la dihidroxiacetona solo posee tres carbonos, los dos carbonos terminales son equivalentes y cualquiera de ellos puede designarse con el número uno). El intermediario enediol a través del que se interconvierten es inestable y no puede aislarse.

D-gliceraldehído.
enediol
dihidroxicetona
II. Enantiómeros
Enantiómeros
Un tipo de estereoisomería es el de las moléculas que son quirales. Una molécula quiral no es superponible con su imagen especular, por lo que la imagen especular es una molécula diferente. Las dos imágenes espejo no idénticas son un par de enantiómeros.
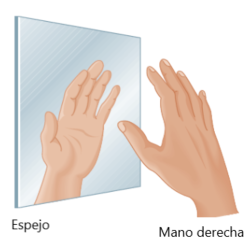

Muchas moléculas igual que el gliceraldehído son quirales, pero afortunadamente no es necesario tener que tratar de sobreponerlas a sus imágenes especulares para determinar si son quirales o no. Una molécula orgánica que contiene un carbono enlazado a cuatro grupos diferentes será quiral y por lo tanto, tendrá una imagen especular no superponible. Un carbono con cuatro grupos diferentes enlazado es llamado carbono quiral.
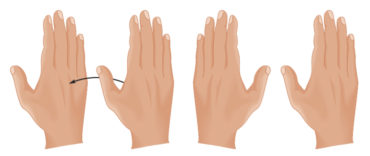
El carbono central del gliceraldehído es quiral porque está enlazado a cuatro grupos diferentes CHO, H, OH, y CH2OH. Como sus manos, los dos enantiómeros del gliceraldehído no se pueden sobreponer. No importa que tanto trate de hacerlo, no hay forma de lograrlo.
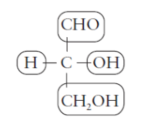
Carbono quiral
D-gliceraldehído L-gliceraldehído
¿Cómo surgen los isómeros ópticos?
Estos dos modelos tienen los mismos grupos unidos al átomo de carbono central, pero son dos moléculas diferentes:
Obviamente, a medida que se dibujan, los grupos naranja y azul no están alineados de la misma manera. ¿Podrían hacer que se alineen rotando una de las moléculas? El siguiente diagrama muestra lo que sucede si rota la molécula B.
Todavía no son lo mismo, y no hay forma de que puedas rotarlos para que se vean exactamente iguales. Estos son isómeros el uno del otro.
¿Qué sucede si dos de los grupos unidos al átomo de carbono central son iguales? El siguiente diagrama muestra esta posibilidad.
Los dos modelos están alineados exactamente como antes, pero el grupo naranja ha sido reemplazado por otro rosado. La molécula B al rotar queda igual que la molécula A. Solo se obtienen isómeros ópticos si los cuatro grupos unidos al carbono central son diferentes.
La diferencia esencial entre los dos ejemplos que hemos analizado radica en la simetría de las moléculas.
Si hay dos grupos iguales unidos al átomo de carbono central, la molécula tiene un plano de simetría. Si imaginas atravesar la molécula, el lado izquierdo es un reflejo exacto del lado derecho.
Donde hay cuatro grupos diferentes unidos, no hay simetría en ninguna parte de la molécula.
carbono con dos grupos iguales
con plano de simetría
carbono con 4 grupos diferentes
sin plano de simetría
Una molécula que no tiene un plano de simetría se describe como quiral. El átomo de carbono con los cuatro grupos diferentes unidos que causa esta falta de simetría se describe como un centro quiral o como un átomo de carbono asimétrico y las dos moléculas formadas que son imágenes especulares que no se pueden sobreponer, se conocen como enantiómeros.
La molécula de la izquierda de arriba (con un plano de simetría) se describe como aquiral.
A diferencia de otros tipos de isómeros, los enantiómeros tienen propiedades físicas y químicas idénticas (excepto aquellas propiedades que implican la interacción con otros objetos quirales). Esto hace que los enantiómeros sean difíciles de separar, y a menudo se usan o encuentran como una mezcla 1:1 de los dos enantiómeros, llamada mezcla racémica o racemato.
Cuando una molécula tiene más de un carbono quiral, cada carbono puede disponerse en la forma derecha o izquierda, por lo tanto, si hay n carbonos quirales, hay 2n posibles estereoisómeros.
Número máximo de isómeros = 2n
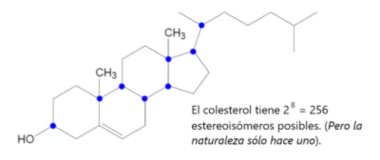
acercamiento a C3 (se ven los cuatro grupos enlazados a C3 que es un carbono quiral). Todos los carbonos señalados como quirales siguen este ejemplo.
Reconocimiento molecular de la epinefrina por un enzima
Sólo el enantiómero levógiro encaja en el sitio activo de la enzima. La naturaleza puede diferenciar fácilmente los enantiómeros. Los sitios activos de las enzimas normalmente se diseñan para alojar solamente uno de los enantiómeros con objeto de formar el complejo enzima-sustrato. El otro enantiómero no encajará en el sitio activo de la enzima, por lo que no mostrará actividad bioquímica.
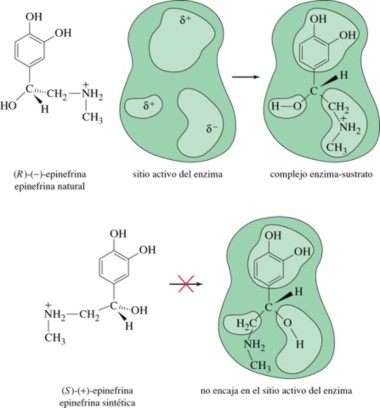
Epinefrina (adrenalina) enlazada a un receptor adrenérgico
epinefrina
interacciones
Actividad óptica
Las moléculas que son enantiómeros tienen exactamente las mismas propiedades físicas (punto de fusión, punto de ebullición, etc.) sólo difieren en su interacción con la luz polarizada.


Una sustancia es levorotatoria (-) cuando rota la luz polarizada hacia la izquierda (ejemplo, la L-glucosa; (-)-glucosa).
Una sustancia es es dextrotatoria (+) cuando rota la luz polarizada hacia la derecha (ejemplo la D-glucosa; (+)-glucosa).
Las moléculas que rotan el plano de la luz polarizada se dice que son ópticamente activas.
La mayoría de las moléculas biológicamente importantes son ópticamente activas. Usualmente, los seres vivos contienen sólo un compuesto de todos los estereoisómeros posibles. En algunos casos, una forma de la molécula es benéfica, y el otro enantiómeros es venenoso (ejemplo, la talidomida).
III. Pentosas
Ribosa y desoxirribosa
Dos pentosas, la ribosa y desoxirribosa, son extremadamente importantes porque se usan en la síntesis de ácidos nucleicos (ADN y ARN), sustancias esenciales en la síntesis de proteínas y la transferencia de material genético. La ribosa (junto con grupos de fosfato) forma las largas cadenas que componen el ácido ribonucleico (ARN). La desoxirribosa (junto con grupos fosfato) forma las cadenas largas de ácido desoxirribonucleico (ADN). La desoxirribosa difiere de la ribosa en que el grupo OH en el carbono 2 ha sido reemplazado por un átomo de hidrógeno (forma desoxi).
Dos pentosas constituyen la estructura de los nucleótidos.
La ß-D-ribofuranosa es uno de los constituyentes del ARN, mientras que la ß-D-2-desoxirribofuranosa forma parte del ácido desoxirribonucleico (ADN). La única diferencia consiste en que en la posición 2 de la pentosa, un grupo -OH ha sido sustituido por un H. Esta pequeña alteración supone que la molécula del ADN sea más resistente a la hidrólisis que el ARN.
ß-D-ribofuranosa
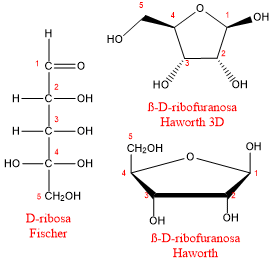
-OH en C2
ß-D-desoxi-ribofuranosa
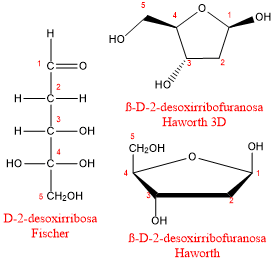
-H en C2
IV. Hexosas
Los monosacáridos a menudo se representan utilizando las estructuras de Haworth que se muestran a continuación para los anillos de furanosa y piranosa.
Los grupos OH restantes en el anillo apuntan hacia arriba o hacia abajo dependiendo de la identidad del azúcar.
Manosa
La manosa desempeña una importante función en la fisiología humana. Sin embargo, no existe necesidad nutricional para esta sustancia, ya que el cuerpo fácilmente puede producirla a partir de la glucosa. No obstante, se pueden encontrar cantidades considerables en muchas frutas y verduras, incluyendo duraznos, manzanas, arándanos, judías verdes, col, y tomates.
carbono anomérico

Glucosa
La principal función de la glucosa (también conocida como dextrosa) en nuestro organismo es producir energía, que utilizan las células para llevar a cabo todos los procesos que ocurren en nuestro cuerpo, como la digestión, la reparación de los tejidos, la multiplicación de nuestras células, etc.
carbono anomérico

Cuando se ponen en disolución, las estructuras cíclicas de los carbohidratos de cinco y seis átomos de carbono se abren y se cierran por un proceso que se conoce como mutarrotación. La α-D-glucosa se convierte en ß-D-glucosa y viceversa. En un momento dado se forma solo una pequeña cantidad de cadena abierta.
Las formas cíclicas de los monosacáridos resultan de la capacidad de su grupo carbonilo para reaccionar intramolecularmente con un grupo hidroxilo. El resultado es un hemiacetal cíclico

formación del hemiacetal.
formación de ß-D-glucopiranosa
orientación de grupos en la ß-glucopiranosa
orientación de grupos en la α-glucopiranosa
Conformación de silla
forma de silla
Galactosa
Es convertida en glucosa en el hígado como aporte energético. Además, forma parte de los glucolípidos y las glucoproteínas de las membranas celulares, sobre todo de las neuronas.
La D-(+)-galactosa es un componente de muchos polisacáridos. Se obtiene por la hidrólisis ácida de la lactosa (azúcar de la leche), disacárido de D-glucosa y D-galactosa. La L-(-)-galactosa también existe en la naturaleza, y se prepara por la hidrólisis de la linaza y del agar. La d-(1)-manosa se obtiene principalmente por la hidrólisis del polisacárido de la nuez de marfil, una semilla grande, semejante a la nuez, obtenida de una palma sudamericana.
carbono anomérico

Fructosa
La fructosa es la cetohexosa más importante. También se conoce como levulosa y, debido a su presencia en muchas frutas, también se conoce como azúcar de fruta. Está presente en la miel en una proporción de 1:1 con glucosa y es abundante en jarabe de maíz. Es el azúcar más dulce de todos los azúcares más comunes por lo que es utilizada como edulcorante de alimentos ya que se necesita menos fructosa que otros azúcares para lograr el mismo grado de dulzura.
carbono anomérico
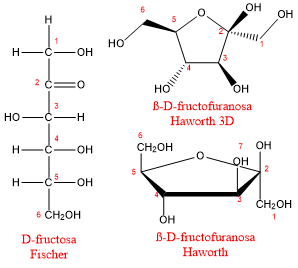
La fructosa tiende a formar un anillo de 5 átomos, una furanosa.
ß-fructoruranosa
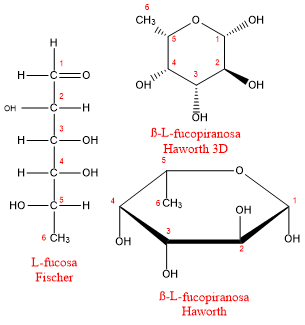
Fucosa
Una variación común en el patrón general de la estructura de los carbohidratos es el reemplazo de uno o más de los sustituyentes hidroxilo por otro átomo o grupo. En los desoxiazúcares, el grupo hidroxilo está sustituido por hidrógeno. Dos ejemplos de desoxiazúcares son 2-desoxi-D-ribosa y L-fucosa.
La L-fucosa, cuya cadena de carbonos termina en un metilo en vez de un grupo CH2OH, se encuentra a menudo como uno de los carbohidratos en glucoproteínas como las de la supericie de los glóbulos rojos que determinan el tipo de sangre
V. Epímeros
Difieren en un solo carbono asimétrico: la D-Manosa es el 2-epímero de la D-Glucosa y la D-Galactosa es el 4-epímero de la D-Glucosa.
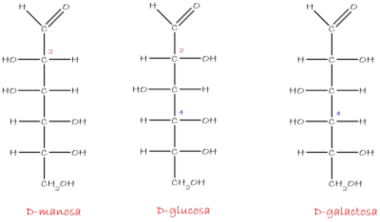
Para escribir la estructura de Fischer de la glucosa como se hizo en la parte superior con el gliceraldehído, la molécula se dibuja en forma de cruz con los carbonos del C2 a C5, el carbono asimétrico en el punto de intersección. Las líneas horizontales representan enlaces dirigidos hacia el observador; las líneas verticales representan enlaces que se alejan del observador.

1. se orienta la molécula colocando su esqueleto en vertical y el grupo aldehído arriba (numeración de arriba abajo);
2. se gira alrededor de un enlace C-C para conseguir que los enlaces C-C del esqueleto queden hacia atrás del átomo quiral que se está considerando en cada caso;
3. observando en esa posición la orientación de todos los grupos OH se define cuál es el estereoisómero.
análisis de posición del -OH
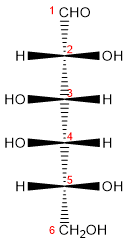
análisis de posición del -OH
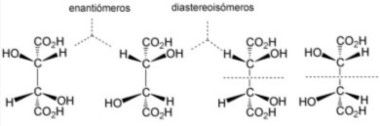
VI. Diastereoisómeros
Si dos moléculas tienen la misma conectividad de enlaces son estereoisómeros. Si son imagen especular una de la otra, se denominan enantiómeros y si no lo son se denominan diastereoisómeros. Alternativamente se puede decir que diastereoisómeros son estereoisómeros que no son enantiómeros.