Diabetes
causas y curas
Estudio Computacional

La diabetes mellitus (DM) es un grupo de enfermedades metabólicas progresivas crónicas con una prevalencia mundial creciente. Se caracteriza comúnmente por hiperglucemia, lo que significa altos niveles de glucosa en la sangre. La causa principal de la diabetes es la ausencia de una hormona llamada insulina (Figura 1) y/o la incapacidad de las células musculares y grasas en el cuerpo para responder a esta hormona y usar glucosa. Aprenda más sobre la insulina.

- Estructura de la insulina humana que muestra su ensamblaje hexamerico (ver archivo PDB en el simulador 3D)
- Evidencia cristalográfica para la coordinación dual alrededor del zinc en el hexámero de insulina humana T3R3 (sitio activo PDB en el simulador 3D)
¿Lo que hay en un nombre?
El término "diabetes mellitus" se deriva de dos palabras: (a) la palabra griega "diabetes" que significa "sifón", que se refiere al aumento de la micción que se observa en esta enfermedad; y (b) la palabra latina "mellitus" que significa "miel o dulce", que se refiere al sabor dulce de la orina causada por el exceso de azúcar en la orina. Curiosamente, hay dos trastornos distintos que comparten el primer nombre de "diabetes": diabetes mellitus y diabetes insípida. Ambas condiciones están asociadas con una producción excesiva de orina y sed constante. Sin embargo, el sello distintivo de la diabetes insípida es la incapacidad de los riñones para conservar el agua, lo que resulta en la excreción de grandes cantidades de orina diluida. Es importante tener en cuenta que las personas diagnosticadas con diabetes insípida no exhiben niveles anormales de glucosa en sangre.
Origen y descubrimiento de la diabetes
La diabetes es una enfermedad antigua: los antiguos egipcios documentaron síntomas clínicos similares a los de la diabetes mellitus en aproximadamente 1500 a. C. Varias civilizaciones antiguas habían registrado el hecho de que la orina de las personas con esta afección tenía un exceso de azúcares (Ahmed, 2002). La condición fue llamada por primera vez "diabetes" por el antiguo médico griego Areteo. Posteriormente, el médico y neuroanatomista británico Thomas Willis agregó el nombre de "Mellitus" al nombre en 1675 después de redescubrir el dulce sabor de la orina y la sangre en los pacientes. En 1889, los científicos alemanes Mering y Minkowski descubrieron el origen pancreático de la diabetes mellitus al demostrar que la pancreactomía (extirpación del páncreas) en un perro podría provocar síntomas similares a la diabetes. En 1910, Sir Edward Albert Sharpey-Schafer, fundador del campo de la endocrinología, descubrió y nombró una hormona "insulina", proponiendo que fuera producida por las células β de los islotes de Langerhans en el páncreas. En 1921 Frederick Banting y su estudiante de medicina Charles Best demostraron que un extracto de proteína del páncreas bovino que contenía insulina podía reducir los niveles de glucosa en sangre y tratar eficazmente a un perro pancreactomizado. Poco después, pudieron aplicar este conocimiento y tratar a pacientes diabéticos con enfermedades terminales al inyectarles insulina. (Consulte la línea de tiempo para obtener más información)
Sobre la insulina
La insulina es una hormona proteica, producida por células específicas en el páncreas llamadas células β (células beta pronunciadas. Es responsable de instruir a las células de nuestro cuerpo (principalmente las células musculares y grasas) para que tomen glucosa de la sangre y la usen como fuente de energía, la almacenen para su uso posterior o promuevan el crecimiento y la proliferación celular. Sin insulina, estas células no pueden usar glucosa y morir de hambre, es decir, los niveles de glucosa en sangre en el individuo pueden ser significativamente altos, sin embargo, un suministro inadecuado de glucosa en las células musculares y grasas (inanición) puede desencadenar la movilización de glucógeno y reservas de grasa. Con el tiempo, el exceso de azúcar en la sangre se une a las proteínas en las células sanguíneas y los tejidos que recubren los vasos sanguíneos mediante un proceso químico llamado glicación. Por otro lado, los perfiles lipídicos anormales, debido al metabolismo lipídico inusual, pueden conducir a la formación de placas y al engrosamiento de las paredes de los vasos sanguíneos. Colectivamente, estos procesos sientan las bases para diversas complicaciones de la diabetes.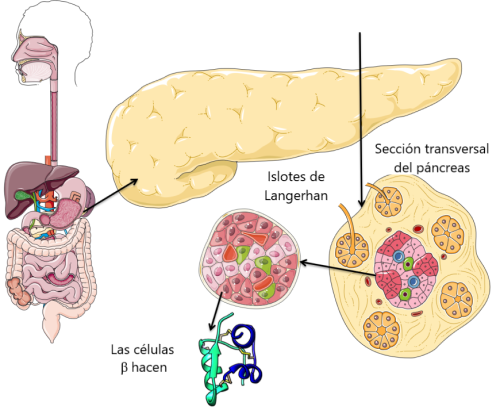
- Estructura de la insulina humana (ver archivo PDB en el simulador 3D)
- Etiquete la cadena A (ver archivo PDB en el simulador 3D)
- Etiquete la cadena B (ver archivo PDB en el simulador 3D)
- Número Cadena A (ver archivo PDB en el simulador 3D)
- Número Cadena B (ver archivo PDB en el simulador 3D)
La glucosa es una fuente de energía clave para todas las células de nuestro cuerpo. Se deriva directamente de los alimentos que comemos (digestión y absorción), y también es suministrado por el hígado, ya sea mediante la descomposición de las reservas de glucógeno (glucogenólisis) o la síntesis de glucosa utilizando otros componentes básicos (gluconeogénesis). La insulina hace que el músculo esquelético y las células lipídicas de nuestro cuerpo absorban glucosa de la sangre. Otra hormona, el glucagón, contrarresta la función de la insulina y facilita la producción de glucosa durante los períodos de inanición.
La ausencia, el suministro inadecuado y la función inadecuada de la insulina son algunas de las principales causas de diabetes. Las causas de la diabetes también se utilizan para clasificar los tipos de diabetes. Por ejemplo:
- Ausencia de insulina: las células pancreáticas que producen insulina son destruidas selectivamente por una respuesta autoinmune, lo que lleva a la diabetes tipo 1
- Resistencia a la insulina: el individuo puede tener cantidades inadecuadas de insulina en el cuerpo o problemas con la función de la insulina, lo que lleva a la diabetes tipo 2
- Suministro inadecuado de insulina: el aumento de peso y la obesidad pueden provocar un desequilibrio en la cantidad de insulina en relación con la sensibilidad de las células a la insulina.
- Función de insulina inadecuada: la insulina se une a su receptor e inicia una cascada de señales en la célula, lo que finalmente conduce a la absorción de glucosa. Las proteínas faltantes o defectuosas en la cascada de señalización (debido a defectos genéticos o mutaciones) y/o cambios en los metabolitos o las moléculas de señalización (como los altos niveles de ácidos grasos libres) pueden alterar el equilibrio metabólico y provocar diabetes.
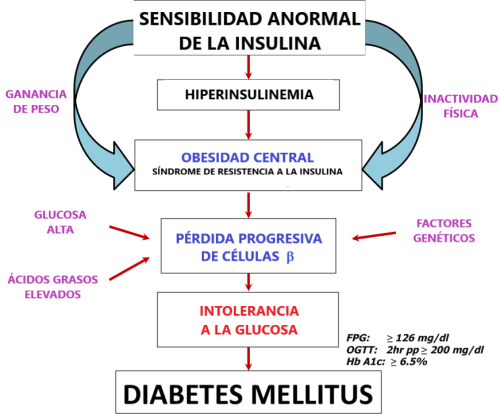
Aunque regular los niveles de glucosa e insulina es fundamental para controlar la diabetes, se está estudiando activamente el papel de los lípidos y diversas moléculas inducidas por el estrés en la causa de la diabetes. Algunas de las causas clave de la diabetes se resumen en la siguiente figura. Tenga en cuenta los impactos de la inactividad física y el aumento de peso.
Uso y almacenamiento de glucosa:
A través de ciclos diarios de ingesta de glucosa (comidas) y ayuno (sueño nocturno), el nivel de glucosa en sangre en individuos normales se mantiene dentro de un rango estrecho entre 4 y 7 mM o 72 a 126 mg / dl (American Diabetes Association, 2009). Este control estricto está mediado principalmente por dos hormonas pancreáticas: insulina y glucagón. Estas dos hormonas también regulan la función del otro: la insulina inhibe la producción de glucosa hepática mientras que el glucagón estimula la producción de insulina.
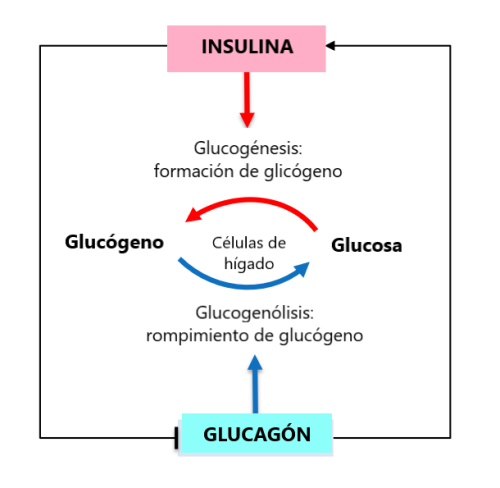
Después de una comida, cuando los niveles de glucosa en sangre aumentan, las células β pancreáticas liberan insulina.
En las células hepáticas, la insulina promueve la glucogénesis, un proceso para convertir el exceso de glucosa en glucógeno para su almacenamiento. Durante los períodos de ayuno, y en presencia de glucagón, el glucógeno almacenado puede convertirse nuevamente en glucosa, mediante un proceso llamado glucogenólisis.
La insulina aumenta la absorción de glucosa en las células musculares y grasas. Dentro de estas células, la glucosa ingresa a la glucólisis y proporciona energía. La insulina también es compatible con la síntesis de lípidos y proteínas y es responsable de promover el crecimiento y la proliferación celular. En las células grasas, la glucosa puede almacenarse como lípidos durante largos períodos de tiempo. En la hambruna extrema, el glucagón puede movilizar estas reservas de lípidos para obtener energía. La interacción de todos los procesos regulados por las hormonas insulina y glucagón (ver archivo PDB en el simulador 3D).
Balance insulina-glucagón
Comparación de las funciones de la insulina y glucagón para mostrar el balance de las dos hormonas.
| Insulina | Glucagón | ||
|---|---|---|---|
| Fuente | Páncreas | Células β | Células α |
| Objetivo | Varios | Músculo, hígado, grasa | Hígado, músculo, riñón |
| Estímulo | Para secreción | Glucosa elevada en la sangre | Glucosa baja en la sangre |
| Efecto | Azúcar/almidón | Glucólisis y glucogénesis | Glucogenólisis y gluconeogénesis |
| Lípidos | Lipogénesis | Lipólisis y cetogénesis | |
| Proteínas | Síntesis de proteínas | Proteólisis |
Tipos de diabetes
- La diabetes tipo 1 se conoce comúnmente como diabetes juvenil o insulinodependiente. Es una afección que generalmente ocurre en niños y adolescentes, que surge de la destrucción inmune (mediada por células T) de las células β pancreáticas productoras de insulina. Los adultos también pueden ser diagnosticados con diabetes tipo 1, también llamada diabetes latente autoinmune en adultos (LADA). La diabetes tipo 1 debe tratarse con insulina exógena.
- La diabetes tipo 2, también conocida como diabetes de inicio en adultos o no dependiente de insulina, se observa con mayor frecuencia en personas mayores y es causada por factores de riesgo relacionados con el estilo de vida y el medio ambiente. La interacción de la resistencia a la insulina leve o severa, la secreción de insulina reducida o insuficiente, y la producción elevada de glucosa crea un ambiente metabólico que conduce a la diabetes, que requiere un tratamiento de vida y/o tratamiento específico de por vida.
- La diabetes gestacional puede desarrollarse en algunas mujeres embarazadas. En general, el embarazo confiere un estado de resistencia a la insulina e hiperglucemia, para permitir que el feto acceda a la glucosa de los suministros de sangre umbilical. Ocasionalmente, la función pancreática de la madre no puede compensar el ambiente diabetógeno del embarazo, y puede considerarse una forma de diabetes tipo 2. Durante el embarazo, los niveles altos de glucosa en la sangre pueden tratarse, ya sea mediante cambios en el estilo de vida y/o medicamentos, para garantizar la salud de la madre y el bebé. A menudo, las mujeres que desarrollan diabetes gestacional están predispuestas a desarrollar diabetes en los años posteriores al embarazo.
- La prediabetes es una afección que precede a la diabetes tipo 2 y se caracteriza por un nivel de glucosa en sangre que es más alto de lo normal pero aún no lo suficientemente alto como para ser diagnosticado y tratado como diabetes. Estas personas también pueden tener un mayor riesgo de enfermedad cardíaca. Las personas con prediabetes suelen desarrollar diabetes tipo 2 dentro de los 10 años posteriores al diagnóstico inicial. Sin embargo, el diagnóstico de diabetes puede retrasarse o evitarse con cambios en el estilo de vida, como actividad física moderada, pérdida de peso moderada y un manejo cuidadoso de la calidad y cantidad de alimentos consumidos.
- La diabetes de inicio en la madurez de los jóvenes (MODY) es una colección de trastornos monogénicos raros caracterizados por (un modo autosómico dominante de) herencia genética y edad de inicio temprano (generalmente menos de 25 años). Estas condiciones diabéticas no dependientes de insulina afectan al 1-2% de los pacientes con diabetes y se caracterizan por una secreción alterada de insulina estimulada por glucosa. En el patrón de herencia autosómico dominante, una copia anormal del gen es suficiente para que un individuo se vea afectado, por lo que hay una probabilidad de 50/50 de que el gen mutante se transmita a las generaciones futuras. A menudo disfrazado de diabetes tipo 1 o diabetes tipo 2, MODY se manifiesta en muchas formas.
- La diabetes secundaria se refiere a una afección en la que surgen síntomas de glucosa elevada en sangre y diabetes como consecuencia de otro estado de enfermedad, como cáncer de páncreas, pancreatitis, fibrosis quística, etc. Algunos medicamentos específicos como los corticosteroides, los antipsicóticos y las estatinas también pueden inducir diabetes. Si bien la causa principal de esta afección no se puede eliminar, este tipo de diabetes puede ser tratada mediante una combinación de cambios en el estilo de vida, medicamentos e insulina.
La hormona insulina ayuda a controlar el nivel de glucosa en la sangre.
Un mensajero molecular
Nuestras células se comunican mediante un sistema postal molecular: la sangre es el servicio postal y las hormonas son las letras. La insulina es una de las hormonas más importantes, y transmite mensajes que describen la cantidad de azúcar disponible en el momento en la sangre. La insulina se produce en el páncreas y se agrega a la sangre después de las comidas cuando los niveles de azúcar son altos. Esta señal luego se extiende por todo el cuerpo, uniéndose a los receptores de insulina en la superficie del hígado, los músculos y las células grasas. La insulina le dice a estos órganos que extraigan glucosa de la sangre y la almacenen en forma de glucógeno o grasa.
Proteínas minúsculas plegables
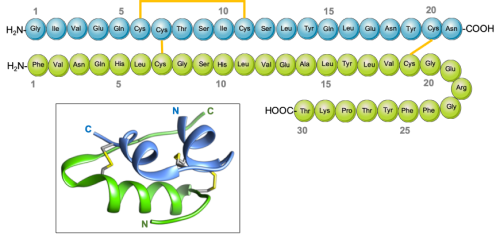
La insulina es una pequeña proteína. Se mueve rápidamente a través de la sangre y es fácilmente capturada por los receptores en las superficies celulares, transmitiendo su mensaje. Las proteínas pequeñas representan un desafío para las células: es difícil hacer una proteína pequeña que se pliegue en una estructura estable. Nuestras células resuelven este problema sintetizando una cadena de proteínas más larga, que se pliega en la estructura adecuada. Luego, la pieza extra se recorta, dejando dos pequeñas cadenas en la forma madura. Estas dos cadenas se muestran en el diagrama inferior en azul y verde, para la insulina de cerdos (entrada PDB 4ins). La estructura se estabiliza aún más mediante tres puentes disulfuro, uno de los cuales se ve en amarillo en cada ilustración.
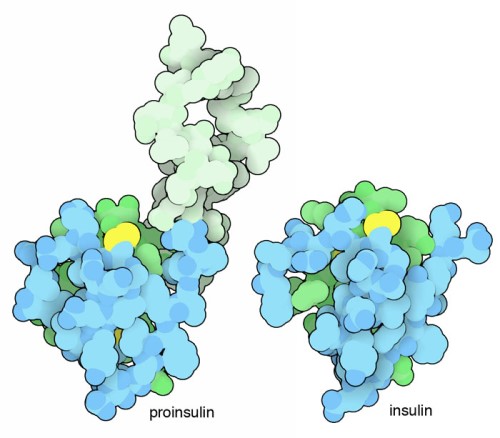
Insulina y proinsulina, con cadena A en verde, cadena B en azul y enlaces disulfuro en amarillo.
Diabetes mellitus
Cuando la función de la insulina se ve afectada, ya sea por daño al páncreas o por los rigores del envejecimiento, los niveles de glucosa en la sangre aumentan peligrosamente, lo que lleva a la diabetes mellitus. Para las personas totalmente deficientes en insulina, como los niños que desarrollan diabetes temprano en la vida, esto puede ser extremadamente peligroso. Los niveles altos de glucosa conducen a la deshidratación, ya que el cuerpo intenta eliminar el exceso de azúcar en la orina y los cambios en el pH de la sangre que amenazan la vida, a medida que el cuerpo recurre a otras moléculas ácidas para la entrega de energía. La diabetes mellitus también tiene graves efectos a largo plazo. Es una de las principales enfermedades crónicas en el mundo industrializado. Los niveles bajos de insulina que pueden ocurrir a medida que envejecemos permiten niveles elevados de azúcar en la sangre durante períodos prolongados de tiempo. Las moléculas de azúcar se unen a las proteínas en todo el cuerpo, comprometiendo su función, y los azúcares derivados de la acumulación de glucosa, distorsionando y obstruyendo las células.
Terapia de insulina
La diabetes mellitus puede tratarse reemplazando manualmente la insulina que falta en la sangre. Por supuesto, necesitamos una fuente abundante de insulina para usar en estos tratamientos. Afortunadamente, la insulina de los cerdos (a la izquierda, entrada de PDB 4ins) difiere de la insulina humana (a la derecha, entrada de PDB 2hiu) por un solo aminoácido: una treonina al final de la cadena en la insulina humana se reemplaza por alanina en la insulina de cerdo. La insulina de las vacas también es muy similar, diferenciándose en solo tres posiciones. Debido a su similitud, estas formas de insulina también son reconocidas por nuestras propias células y pueden usarse en terapia. Hoy en día, la industria de la biotecnología produce insulina humana para su uso en el tratamiento, al diseñar bacterias o levaduras para producir una proteína idéntica a la nuestra. Los investigadores también han diseñado nuevas insulinas con propiedades mejoradas, como se describe en la Molécula del mes sobre las insulinas de diseñador.
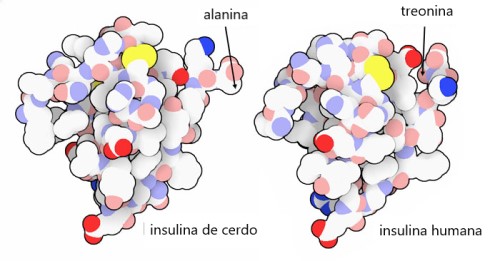
Insulina y proinsulina, con cadena A en verde, cadena B en azul y enlaces disulfuro en amarillo.
Insulina de cerdo (ver archivo PDB en el simulador 3D)
Insulina humana (ver archivo PDB en el simulador 3D)
Las insulinas diseñadas han sido desarrolladas para mejorar el tratamiento de la diabetes.
Hace un siglo, las personas con diabetes mellitus no tenían buenas opciones de tratamiento y la condición médica era invariablemente fatal. El descubrimiento de la insulina revirtió drásticamente esta sombría realidad, y hoy en día, la terapia con insulina permite a las personas con diabetes controlar su enfermedad y, por lo tanto, minimizar el impacto nocivo de los niveles elevados de azúcar en la sangre, mientras viven vidas largas y productivas. Las primeras preparaciones de insulina se extrajeron del ganado (ganado o cerdos). Hoy, la insulina es creada por bacterias preparadas por bioingeniería que fabrican insulina humana pura. La estructura mostrada aquí, a partir de la entrada PDB 1trz, se determinó usando la primera insulina humana recombinante, comercializada como Humulin.
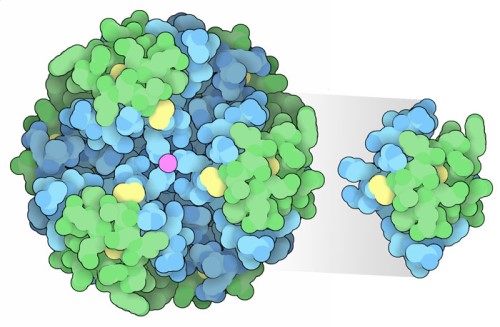
La insulina se almacena dentro de las células pancreáticas especializadas como un complejo hexamérico (izquierda). Está activo como un monómero (derecha) cuando se une a sus receptores. La cadena A se muestra en verde y la cadena B en azul, con enlaces disulfuro en amarillo. Los iones de zinc (magenta) y las interacciones proteína-proteína estabilizan el hexámero.
Insulina humana (ver archivo PDB en el simulador 3D)
Afinando el tratamiento
Cuando se inyecta insulina humana recombinante debajo de la piel, disminuye los niveles de azúcar en la sangre rápidamente, pero sus efectos desaparecen en unas pocas horas. Este enfoque para controlar el azúcar en la sangre funciona bien inmediatamente después de comer, pero las células en nuestros cuerpos también se alimentan entre comidas al movilizar el glucógeno almacenado en los músculos y el hígado. En circunstancias normales, el páncreas secreta continuamente bajos niveles de insulina para controlar los niveles de azúcar en la sangre cuando estamos en ayunas. Poco después de que la Administración de Drogas y Alimentos de los EE. UU. aprobara la insulina humana recombinante, los científicos comenzaron a intentar crear otra forma de insulina genéticamente modificada que actúe durante más tiempo, para ayudar a proporcionar un control basal del azúcar en la sangre.
Insulina de acción prolongada
El truco para crear insulina de acción prolongada se inspiró en nuestro conocimiento de su estructura. La insulina se almacena en el páncreas como un complejo hexamérico (ver archivo PDB en el simulador 3D), que luego se desmorona para formar el monómero activo cuando se libera en el torrente sanguíneo y se une a los receptores de insulina, que se encuentran en la superficie de la mayoría de las células del cuerpo humano. Para hacer una molécula de acción prolongada, necesitamos ralentizar la aparición del monómero activo. El primer enfoque exitoso combina la insulina con una proteína de pescado, la protamina, para crear un complejo heterogéneo que se disuelve lentamente en la sangre. Luego, los investigadores diseñaron nuevas insulinas que hacen algo similar. Agregaron dos aminoácidos de arginina, y luego cambiaron una asparagina a glicina, para cambiar el carácter químico de la insulina. El resultado final es la glargina (Lantus ®) (ver archivo PDB en el simulador 3D), una insulina de acción prolongada que es menos soluble al pH normal del cuerpo, formando agregados que liberan lentamente el monómero activo.
Interacciones a medida
Las insulinas de acción prolongada también se han creado al unir largas cadenas de hidrocarburos a la hormona. Esta modificación reúne varios hexámeros, formando un agregado de hexámeros de insulina que se disuelve lentamente en la sangre. También estabilizan las interacciones con la albúmina sérica de proteínas de la sangre, lo que extiende aún más la acción de esta insulina de diseño. La estructura que se muestra aquí es la de degludec (Tresiba®) Insulina humana (ver archivo PDB en el simulador 3D). En esta forma cristalina, una de las une dos hexámeros, dando una pista de cómo estas hormonas de diseño podrían formar agregados de orden superior después de que se inyectan debajo de la piel.
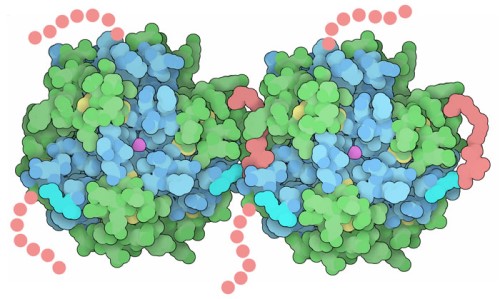
Degludec es una insulina de diseño con una larga cadena de hidrocarburos (rosa) unida en el extremo C de cada cadena B. Aparentemente, estas cadenas son bastante móviles y solo dos de las seis están lo suficientemente localizadas como para resolverse en la estructura cristalográfica: una vista aquí en el lado derecho de cada hexámero y la otra oculta en esta vista.
Las insulinas de acción prolongada se combinan con las insulinas de acción rápida que se usan inmediatamente después de las comidas. El truco molecular para crear una insulina de acción rápida es desestabilizar el hexámero de insulina, por lo que se desmorona rápidamente cuando ingresa al torrente sanguíneo. El primer diseño de acción rápida, lispro (Humalog ®), involucró los cambios más pequeños en la molécula, invirtiendo el orden de dos residuos cerca del extremo C de la cadena B. Este cambio debilita la interacción entre los monómeros de insulina, haciendo que el hexámero mutante sea 200 veces menos estable que la forma nativa (entrada PDB 1lph). Un estudio adicional de la estructura de la insulina mostró que la adición de un aminoácido cargado en la misma ubicación logra el mismo resultado, produciendo el asparto de insulina de acción rápida (Novolog®) (entrada PDB 4gbc). Para explorar estas estructuras con más detalle, haga clic en la imagen para un JSmol interactivo.
Las insulinas de acción rápida están diseñadas debilitando la interacción entre las cadenas B (mostradas en azul oscuro aquí). En la insulina humana, los dos últimos aminoácidos son prolina (esferas blancas) y lisina (esferas turquesas). En la insulina de acción rápida Humalog, estos dos se cambian. En la insulina Aspart, la prolina se cambia a aspartato (esferas rosadas). Use los botones para cambiar entre las tres estructuras.
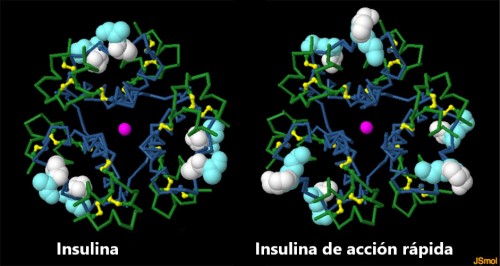
- Ver insulina nativa en el simulador 3D.
- Ver insulina Humalog en el simulador 3D.
- Ver insulina Aspart en el simulador 3D.
Sorprendentemente, las pequeñas moléculas conservantes como el fenol y el cresol juegan un papel importante en la terapia con insulina, estabilizando el hexámero hasta que llega al torrente sanguíneo. Muchas de las estructuras de insulina en el archivo PDB incluyen varias de estas moléculas, estabilizando las interacciones entre las cadenas en el hexámero.
Los investigadores también están buscando formas de diseñar moléculas de insulina ultraestables que tengan una sola cadena. Mire, por ejemplo, la del archivo PDB con 57 aminoácidos .
El receptor celular de insulina ayuda a controlar la utilización de glucosa por las células.
Las células de todo el cuerpo son alimentadas en gran medida por la glucosa que se entrega a través del torrente sanguíneo. Se utiliza un sistema de señalización complejo para controlar el proceso, asegurando que la glucosa se entregue cuando sea necesario y se almacene cuando haya un excedente. Dos hormonas, la insulina y el glucagón, están en el centro de este sistema de señalización. Cuando los niveles de glucosa en la sangre caen, las células alfa en el páncreas liberan glucagón, que luego estimula las células del hígado para liberar glucosa en la circulación. Cuando los niveles de glucosa en sangre aumentan, por otro lado, las células beta en el páncreas liberan insulina, lo que promueve la absorción de glucosa para el metabolismo y el almacenamiento. Ambas hormonas son proteínas pequeñas que son reconocidas por los receptores en la superficie de las células.
Transducción de señales
El receptor de insulina es una proteína grande que se une a la insulina y transmite su mensaje a la célula. Tiene varias partes funcionales. Dos copias de las cadenas de proteínas se unen en el exterior de la célula para formar el sitio receptor que se une a la insulina. Esto está conectado a través de la membrana a dos tirosina quinasas, que se muestran aquí en la parte inferior. Cuando la insulina no está presente, se mantienen en una posición restringida, pero cuando la insulina se une, se liberan estas restricciones. Primero fosforilan y se activan entre sí, y luego fosforilan otras proteínas en la red de señalización dentro de la célula. Dado que todo el receptor es tan flexible, los investigadores han determinado su estructura en varias partes: la porción de unión a la insulina se muestra aquí desde la archivo PDB , el segmento transmembrana de (ver archivo PDB ) y la tirosina quinasa de (ver archivo PDB ).
Cuando las cosas van mal
Los problemas con la señalización de la insulina pueden afectar el manejo adecuado de los niveles de glucosa en la sangre, lo que lleva a la enfermedad generalizada diabetes mellitis. Hay dos formas comunes en que esto sucede. La diabetes tipo I es causada por problemas con la insulina: en algunos casos, las células pancreáticas que producen insulina son destruidas por la autoinmunidad, y en otros casos la insulina está mutada e inactiva. Esto a menudo ocurre temprano en la vida y requiere tratamiento con insulina para reemplazar la insulina faltante. La diabetes tipo II, por otro lado, con mayor frecuencia ocurre más adelante en la vida y es causada por una resistencia adquirida a la acción de la insulina en su receptor. Los detalles son complejos e implican la fosforilación del receptor y sus sustratos, modificando su acción en la señalización de insulina. La condición se trata con especial atención a la dieta, el estilo de vida y la medicación.
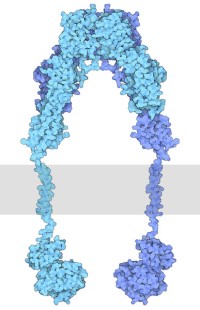
Receptor de insulina, con la porción extracelular en la parte superior, la porción intracelular en la parte inferior y la membrana celular mostrada esquemáticamente en gris.
Unión de insulina
Cuando la insulina se une al receptor, se cree que causa un cambio en la forma que se propaga dentro de la célula, activando las tirosina quinasas. Los detalles siguen siendo un misterio y un área de investigación activa. Una estructura reciente de insulina unida a una porción del receptor (insulina mostrada aquí en rojo desde la archivo PDB ) coloca otra pieza en el rompecabezas. Sorprendentemente, la insulina se une al borde exterior del receptor, y típicamente solo se une a un lado del receptor simétrico.
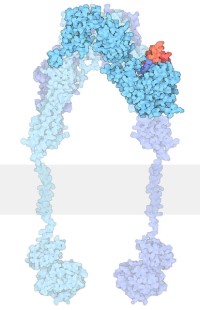
Porción extracelular del receptor de insulina (azul) unida a la insulina (rojo).
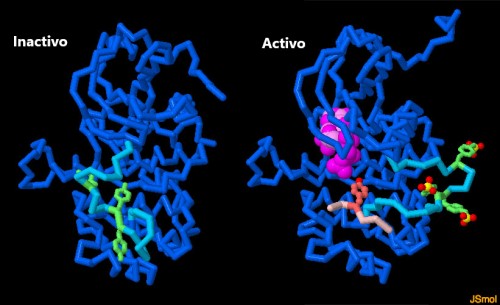
La porción de tirosina quinasa del receptor es en sí misma una proteína dinámica con muchas partes móviles. El sitio activo se une al ATP y lo usa para fosforilar sus objetivos. En el estado inactivo (que se muestra a la izquierda, archivo PDB ), un bucle móvil (en turquesa brillante) se une en el sitio activo, bloqueando su acción. Cuando se activa el receptor, varias tirosinas (verdes) en este bucle se fosforilan, lo que hace que salga del sitio activo, permitiendo que ingrese ATP (magenta) (se muestra a la derecha, archivo PDB ). Otras proteínas de señalización (un péptido pequeño de uno se muestra en rosa) luego se unen y se fosforilan en sus aminoácidos de tirosina. Para explorar estas dos estructuras con más detalle, haga clic en la imagen para un JSmol interactivo.