Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
- Superficie VDW, la superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.

Aminas y Amidas
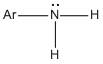
Alquilaminas: Como se muestra en la siguiente figura, la metilamina, al igual que el amoniaco, tiene un arreglo piramidal de los enlaces con el nitrógeno. Sus ángulos H - N - H (106°) son un poco menores que el valor tetraédrico de 109.5°, mientras que el ángulo C — N — H (112°) es un poco mayor. La distancia del enlace C — N, 1.47 Å, está entre las distancias características de C — C en los alcanos (1.53 Å) y las del enlace C — O en los alcoholes (1.43 Å).
El nitrógeno y el carbono tienen hibridación sp3, y están unidos por un enlace σ en la metilamina. El par electrónico no compartido del nitrógeno ocupa un orbital híbrido sp3. Ese par no compartido interviene en reacciones en las que las aminas se comportan como bases o nucleófilos. El mapa de potencial electrostático de la metilamina muestra con claridad la concentración de la densidad electrónica en el nitrógeno.
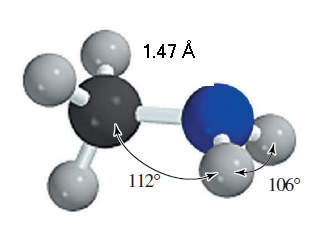
Medidas de la metilamina.
Puede variar por el cálculo computacional de minimización.
Arilaminas: La anilina, al igual que las alquilaminas, tiene un arreglo piramidal de enlaces en torno al nitrógeno, pero esa pirámide es algo más plana. Una medida del grado de esta planaridad se observa en el ángulo entre el enlace carbono-nitrógeno y la bisectriz del ángulo H — N — H.
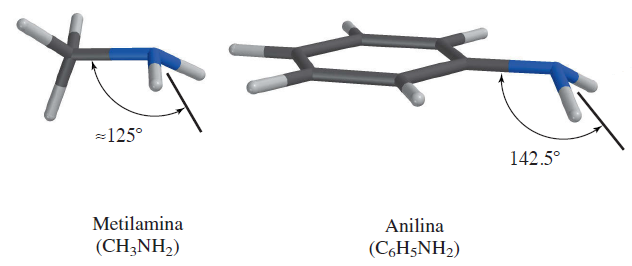
Ángulos de enlace de metilamina y anilina
Clasificación de las Aminas
A diferencia de los alcoholes y los halogenuros de alquilo, que se clasiican como primarios, secundarios o terciarios de acuerdo con el grado de sustitución del carbono que lleva el grupo funcional, las aminas se clasifican de acuerdo con su grado de sustitución en el nitrógeno. Una amina con un carbono unido al nitrógeno es una amina primaria; una amina con dos carbonos es una amina secundaria y una amina con tres es una amina terciaria.
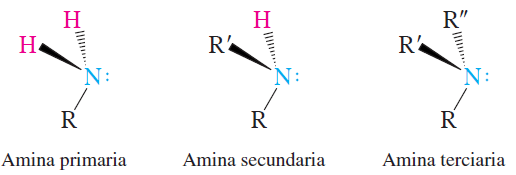
Clasificación de aminas
Los grupos unidos al nitrógeno pueden ser cualquier combinación de grupos alquilo o arilo.
Aminas primarias
Clasificación de Aminas.
Atención!
Si un grupo -R reemplaza uno de los átomos de hidrógeno de una molécula de amoníaco, se produce una amina primaria (1a). Si dos de los átomos de hidrógeno del NH3 se reemplazan por dos grupos R, se produce una amina secundaria (2a). Si los tres átomos de hidrógeno del NH3, se reemplazan por tres grupos R se produce una amina terciaria (3a)..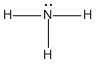
Amoniaco
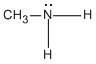
Amina Primaria
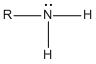
Estructura General
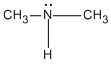
Amina Secundaria
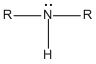
Estructura General
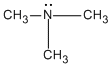
Amina Terciaria
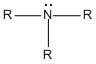
Estructura General
Las aminas se dividen, además, en aminas alifáticas y aromáticas. En una amina alifática, todos los carbonos enlazados directamente con el nitrógeno se derivan de grupos alquilo; en una amina aromática, uno o más de los grupos enlazados directamente con el nitrógeno son grupos arilo.

Amina Alifática

Estructura General
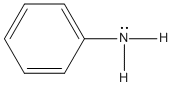
Amina Aromática
Estructura General
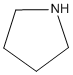
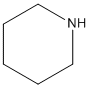
Aminas Heterocíclicas Alifáticas
Una amina en la cual el átomo de nitrógeno forma parte del anillo se clasifica como amina heterocíclica.
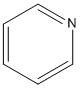
Aminas Heterocíclicas Aromáticas
Polaridad de las Aminas
La polaridad de las aminas depende de la electronegatividad del nitrógeno y de los sustituyentes que se unen a él. El nitrógeno es más electronegativo que el carbono y el hidrógeno, por lo que atrae más los electrones hacia sí y genera un momento dipolar en la molécula. Las aminas pueden formar puentes de hidrógeno con el agua u otras moléculas polares, lo que aumenta su solubilidad y sus puntos de fusión y ebullición. Las aminas alifáticas son más polares que las aromáticas, ya que estas últimas tienen un anillo bencénico que disminuye el momento dipolar del nitrógeno. Las aminas primarias y secundarias son más polares que las terciarias, ya que tienen más enlaces N-H que contribuyen al momento dipolar y a la formación de puentes de hidrógeno.