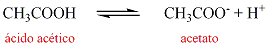Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
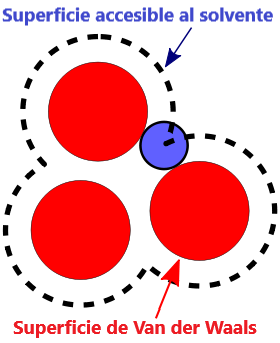
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Cargas parciales, para ver el valor de la carga relativa positiva o negativa de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Soluciones Reguladoras
Una solución tampón, también conocida como buffer o solución reguladora, es una solución química que se utiliza para mantener el pH estable en un sistema químico, incluso cuando se añaden ácidos o bases. El pH es una medida de la acidez o basicidad de una solución, y un cambio significativo en el pH puede afectar la reactividad química, la solubilidad de los compuestos y la estabilidad de las biomoléculas.
Las soluciones tampón son importantes en muchos campos de la química y la biología, como la investigación en laboratorios, la producción de productos farmacéuticos, la elaboración de alimentos y bebidas, la purificación de agua y la gestión ambiental. Las soluciones tampón se pueden preparar a partir de una combinación de un ácido débil y su base conjugada, o de una base débil y su ácido conjugado.

Puede haber soluciones reguladoras ácidas que tienen valores de pH por encima de 7, y soluciones reguladoras básicas con valores de pH menores de 7. Las soluciones reguladoras ácidas se preparan a partir de mezclas de ácidos débiles y sus bases conjugadas, las soluciones reguladoras básicas se preparan a partir de mezclas de bases débiles y sus ácidos conjugados.
Las reacciones químicas que ocurren en nuestro cuerpo generalmente requieren un pH específico. Los catalizadores que permiten que estas reacciones ocurran a un ritmo razonable son muy sensibles al pH de su entorno, y se dañan o destruyen si el pH cambio un poco de su valor normal. Paradójicamente, muchas de estas reacciones producen productos ácidos o básicos que pueden cambiar el pH lo suficiente como para destruir las moléculas que los catalizan. Por ejemplo, cuando usted participa en ejercicio extenuante, su cuerpo descompone la (azúcar en la sangre) en para producir energía.

Incluso pequeñas cantidades de ácido láctico pueden tener un impacto dramático en el pH. Si tu cuerpo descompone solo 1 g de glucosa, producirá suficiente ácido láctico para reducir el pH de 3 L de agua (el volumen aproximado de plasma sanguíneo en un adulto) de 7.0 a 3.2. Tal cambio de pH sería letal. El pH del plasma sanguíneo se mantiene normalmenteen el rango de 7. 35 a 7.45, y un pH plasmático por debajo de 6.8 causa la muerte en cuestión de segundos. Sin embargo, el pH del plasma se mantiene prácticamente constante durante el ejercicio extenuante. El pH de la mayoría de las soluciones acuosas en el cuerpo se mantiene a un nivel constante por un tampón.
Un buen ejemplo de una solución reguladora es la sangre que tiene un pH de 7.35. La adición de "pequeñas" cantidades de ácido o base a la sangre, hará que ésta cambie su valor de pH relativamente poco en el orden de unas pocas centésimas.
En la siguiente tabla se puede observar algunos ejemplos de soluciones reguladoras en el rango de pH en el cual éstas tienen su máxima capacidad de actuar.
Ácido débil |
Fórmula |
Base conjugada |
Fórmula |
Rango de pH |
Ácido acético |
CH3COOH |
acetato |
CH3COO- |
3.6 - 5.8 |
Ácido carbónico |
H2CO3 |
bicarbonato |
HCO3- |
5.4 - 7.4 |
Ácido fórmico |
HCOOH |
formiato |
HCOO- |
2.7 - 4.7 |
Ácido fluorhídrico |
HF |
fluoruro |
F- |
2.2 - 4.2 |
Base débil |
Fórmula |
ácido conjugado |
Fórmula |
Rango de pH |
Amoníaco |
NH3 |
amonio |
NH4+ |
8.2 - 10.2 |
Carbonato |
CO3-2 |
bicarbonato |
HCO3- |
9.3 - 11.3 |
Fosfato |
fosfato |
fosfato hidrogenado |
HPO4-3 |
11.6 - 13.6 |
Ecuaciones de Equilibrio
A continuación se muestran las ecuaciones de equilibrio entre el ácido o base débil y su correspondiente ácido o base conjugada para los ejemplos de la tabla anterior:
- Ácido Acético
- Ácido carbónico:
- Ácido fórmico:
- Ácido fluorhídrico
- Amoníaco:
- Carbonato:
- Fosfato: