Instrucciones
Cargar archivo PDB
Diferentes formas de representación de las moléculas
- "Amino" es un esquema que asigna colores a los aminoácidos en función de sus propiedades químicas, p. ácido, básico, hidrofóbico o polar. Los colores son ASP, GLU, CYS, MET, LYS, ARG, SER, THR, PHE, TYR, ASN, GLN, GLY, LEU, VAL, ILE, ALA, TRP, HIS y PRO. Los ácidos nucleicos son de color caré claro en el esquema "amino".
- "Cadena" es un esquema que da un color diferente a cada cadena del archivo pdb.
- "Grupo" es un esquema que colorea las cadenas de proteínas de manera diferencial en la dirección amino-carboxi. Este esquema también colorea las cadenas de ácido nucleico de manera diferencial en la dirección 5 '> 3'.
- "Temperatura" es un esquema que colorea los átomos de acuerdo con sus temperaturas anisotrópicas, almacenadas como un valor beta en un archivo pdb. La temperatura anisotrópica indica la movilidad de un átomo o la incertidumbre de posición. Los segmentos más "móviles" y más cálidos son de color rojo, progresando a fragmentos azules más inmóviles.
- "Estructura" es un esquema de color muy útil porque colorea de manera diferencial la estructura secundaria de una proteína (hélices α y láminas β). Es mejor usar un comando de visualización que ilustre la estructura secundaria cuando se utiliza el esquema de colores de la estructura (por ejemplo, cintas, dibujos animados, esqueleto, trazas o hebras; consulte la sección Visualización).
Clasificación de los aminoácidos
- Ácidos: Asp, Glu
- No cíclicos
- Alifáticos: Ala, Gly, Ile, Leu, Val
- Aromáticos: His, Phe, Trp, Tyr
- Básicos: Arg, His, Lys
- Interiores: Ala, Leu, Val, Ile, Phe, Cys, Met, Trp
- Con carga: Asp, Glu, Arg, His, Lys
- Hidrofóbicos: Ala, Leu, Val, Ile, Pro, Phe, Met, Trp
- Polares: Cys, Gly, Ser, Thr, Lys, Asp, Asn, Glu, Arg, Gln, Tyr, His
- Pequeños: Ala, Gly, Ser
Metales
Grupos Prostéticos
Superficie y Cavidades
Sección
Introducción
Osteopenia
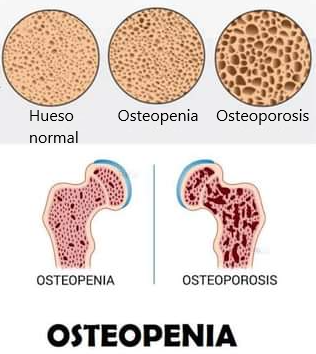
Comparación entre un hueso normal, con osteopenia y osteoporósis.
Linda era una mujer hermosa y delgada que parecía mucho más joven que sus 67 años. La mayor parte de su vida había sido cuidadosa de su peso y de mantener su figura. Ella fue al gimnasio regularmente y se consideró muy en forma. Recientemente, sin embargo, se le había diagnosticado osteopenia, que es una condición de tener una densidad menor a la óptima, que puede progresar a la condición más grave de osteoporosis, que es baja densidad ósea. Su médico no sólo recomendó suplementos de calcio y vitamina D, sino también un aumento de la ingesta de proteínas. Le parecía extraño a Linda que recomendara proteínas si el problema era su densidad ósea. Él explicó que ella estaba en un riesgo aún mayor de fracturas si no tenía masa muscular adecuada. La idea de una mayor ingesta de cualquier alimento no era de su agrado porque siempre había mantenido control sobre su dieta y ni había comido nunca mucha carne.
El hueso es aproximadamente 50% de matriz proteica. La evidencia reciente sugiere que el aumento de la proteína dietética es importante para los ancianos porque la capacidad de construir el hueso y el músculo de la proteína dietética disponible disminuye con la edad. Para una mujer de 120 libras, 65 g de proteína cumpliría con la recomendación más alta. Con un valor calórico de 260 calorías, 65 gramos de proteína podría causar un aumento de peso indeseable si se agrega simplemente a una dieta existente. Sin embargo, la sustitución cuidadosa podría aumentar la ingesta de proteínas sin causar un aumento de peso.
¡Definición!
Estructura
Es la manera como se organiza una proteína para adquirir cierta forma. Presentan una disposición característica en condiciones fisiológicas, pero si se cambian estas condiciones como temperatura, pH, etc. pierde la conformación y su función, proceso denominado desnaturalización. La función depende de la conformación y ésta viene determinada por la secuencia de aminoácidos.
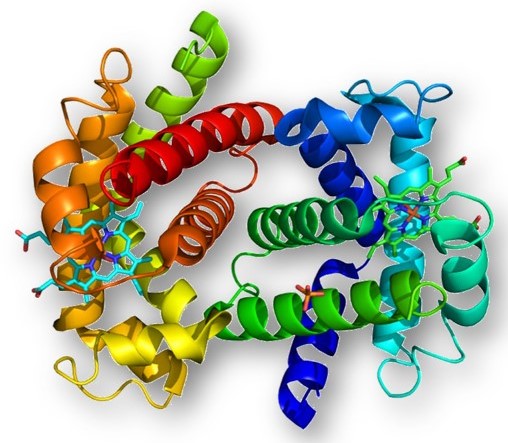
Modelo computacional de una proteína.
Clasificación
Las proteínas son polímeros lineales de α-aminoácidos con amplia variabilidad estructural y funciones biológicas muy diversas.
La variedad de proteínas es elevadísima, y para su clasificación se suele recurrir a:
Criterio Físico
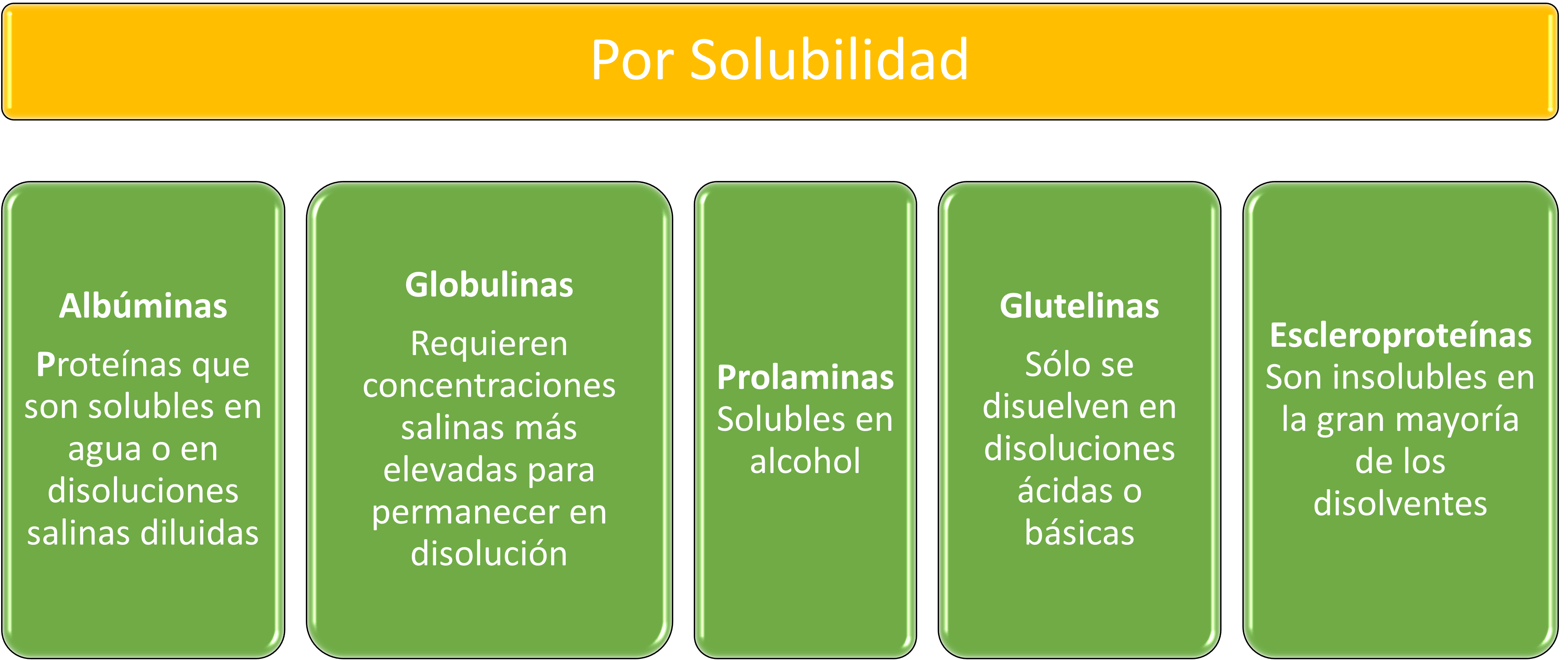
Clasificación de las proteínas por su solubilidad.
Albúminas
Proteínas que son solubles en agua o en disoluciones salinas diluidas.
Globulinas
Proteínas que requieren concentraciones salinas más elevadas para permanecer en disolución.
Prolaminas
Son solubles en alcohol.
Glutelinas
Sóólo se disuelven en disoluciones ácidas o básicas.
Escleroproteínas
Son insolubles en la gran mayoría de los disolventes
Criterio Químico
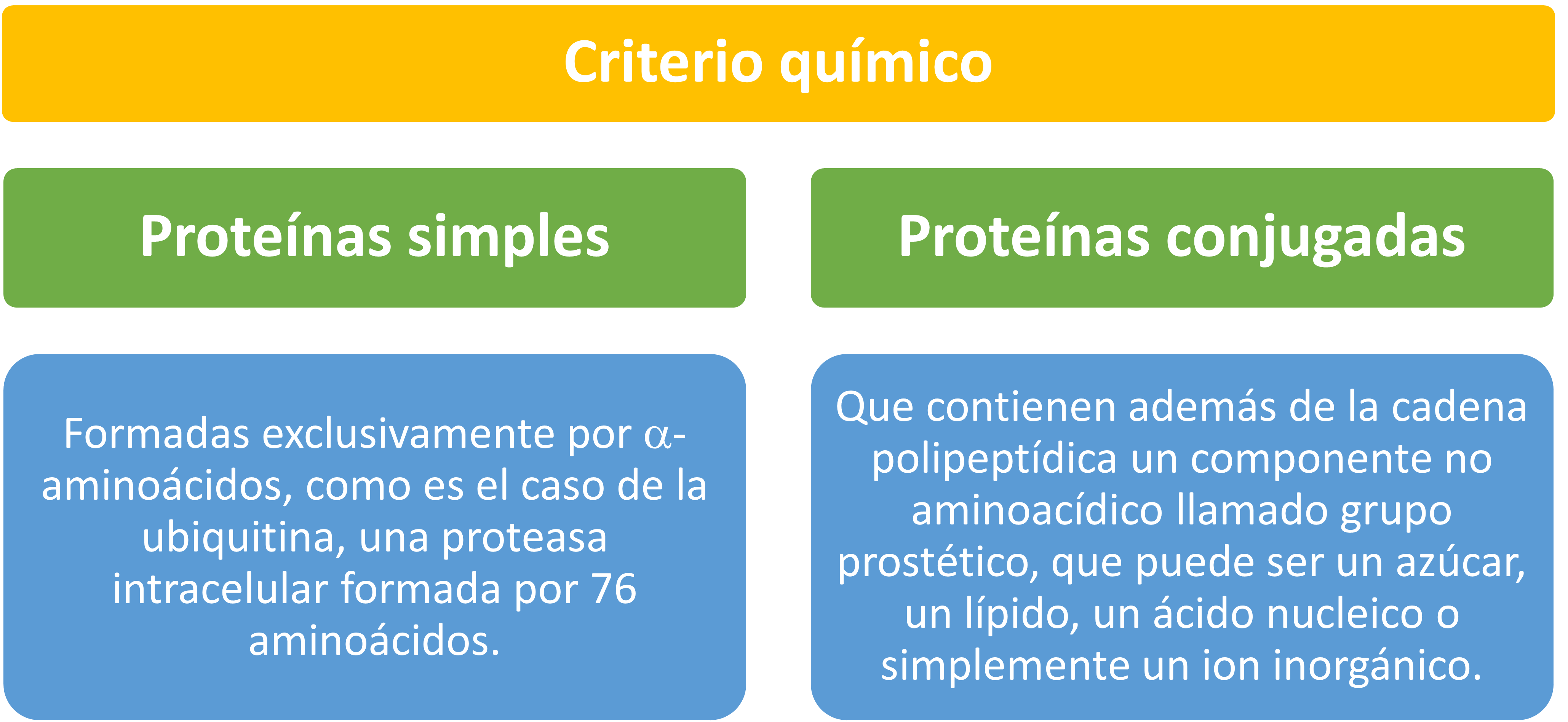
Proteínas Simples
Formadas exclusivamente por α-aminoácidos, como es el caso de la , una proteasa intracelular formada por 53 aminoácidos.
Proteínas Conjugadas
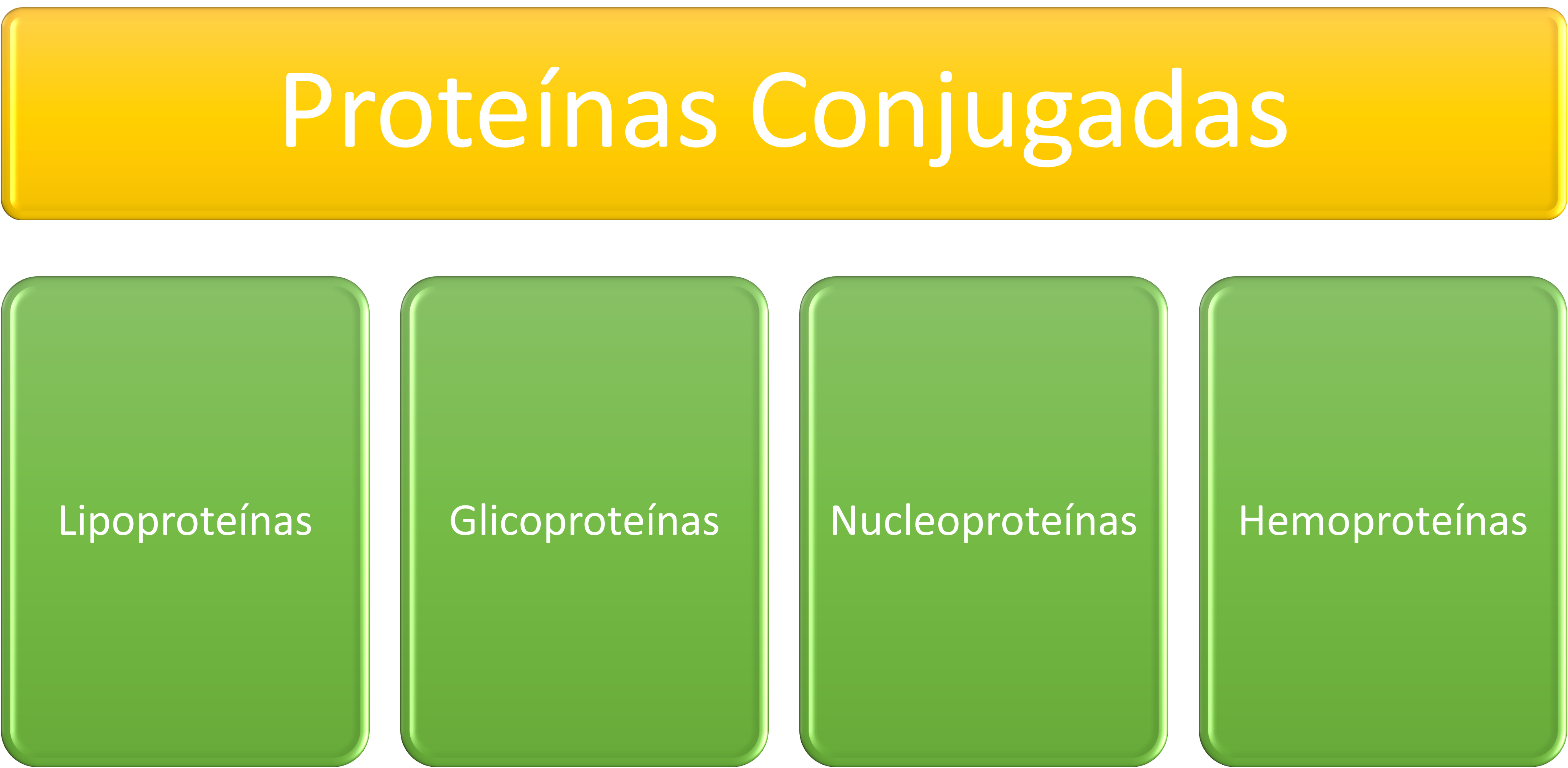

Contienen además de la cadena polipeptídica un componente no aminoacídico llamado grupo prostético, que puede ser un azúcar, un lípido, un ácido nucleico o simplemente un ion inorgánico. La proteína en ausencia de su grupo prostético no es funcional, y se llama apoproteína. La proteína unida a su grupo prostético es funcional, y se llama holoproteína (holoproteína = apoproteína + grupo prostético). Son proteínas conjugadas la , la , que se encuentra en los músculos (este modelo muestra a la mioglobina que tiene un grupo hemo con un Fe+2 en el centro que se combina O2), los citocromos, etc. Ejemplo, el , donde el grupo prostético es el grupo .
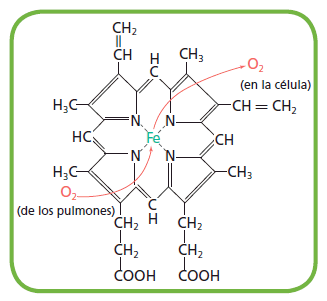
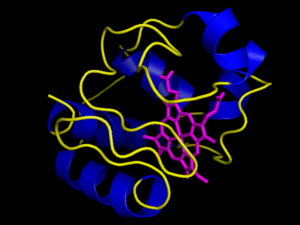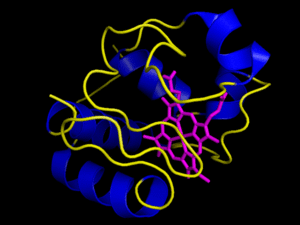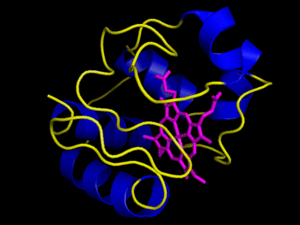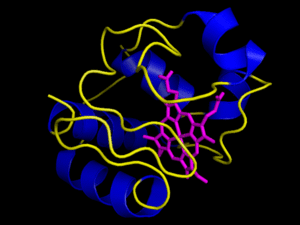
Grupo hemo.
Algunas proteínas conjugadas más importantes son: las lipoproteínas, las glicoproteínas, las nucleoproteínas y las hemoproteínas.
Las lipoproteínas son proteínas conjugadas compuestas de lípidos y proteínas. Ayudan a suspender y transportar los lípidos a través del torrente sanguíneo. Generalmente se clasifican según su densidad: muy baja densidad (VLDL), baja densidad (LDL), alta densidad (HDL), y muy alta densidad (VHDL). Un ejemplo de una lipoproteína es archivo PDB , en donde se puede observar en la parte central y de color gris, una molécula de un esteroide. Las lipoproteínas son agregados de proteínas y moléculas lipídicas, contienen una parte interior hidrofóbica (no polar) y una parte exterior hidrofílica (polar), muy similar a la estructura de una micela. Las micelas se forman en medio acuoso. En ellas, las colas hidrofóbicas quedan hacia el interior mientras que las cabezas polares (carboxilato) están en la superficie, en contacto con el agua. Pueden considerarse como una minúscula gota de lípido delimitada por grupos polares en contacto con el agua. Los lípidos no solubles en agua quedan atrapados en el interior de la micela, y ésta puede ser arrastrada por la disolución. Es el llamado efecto detergente. Las disoluciones micelares reciben el nombre de emulsiones, y las moléculas que pueden formarlas se llaman emulsionantes o detergentes. Debido al tamaño del soluto, las disoluciones micelares son disoluciones coloidales.
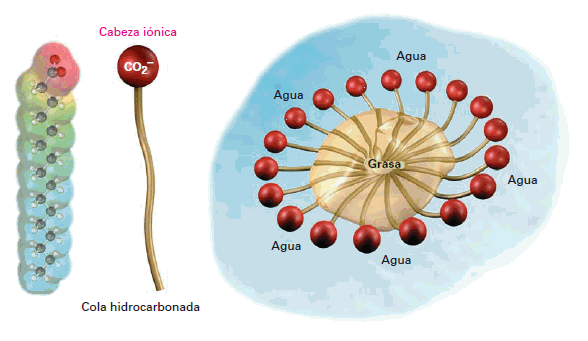
Estructura de una micela.
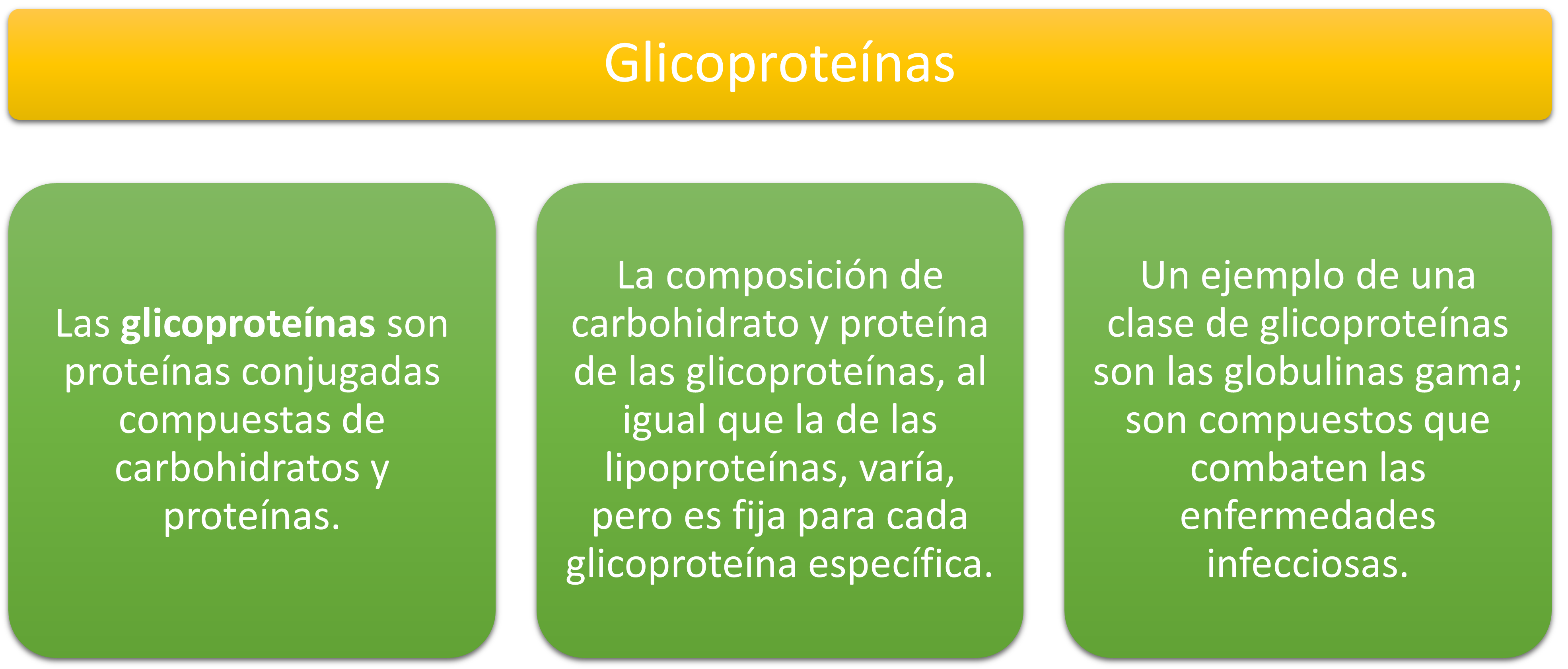
Glicoproteínas y glucoproteínas

Glicoproteínas y glucoproteínas
Criterios estructurales (de forma)
En cuanto a su forma molecular, podemos distinguir:
Proteínas Globulares
Se dispersan en agua, es decir, forman dispersiones coloidales. Como ejemplos de proteínas globulares se encuentran las enzimas. las inmunoglobulinas (anticuerpos) y las proteínas de la sangre. La cadena polipeptídica aparece enrollada sobre sí misma dando lugar a una estructura más o menos esférica y compacta. Un ejemplo de este tipo de proteína puede ser la . Las principales clases de proteínas globulares son: las albúminas, las globulinas y las histonas.
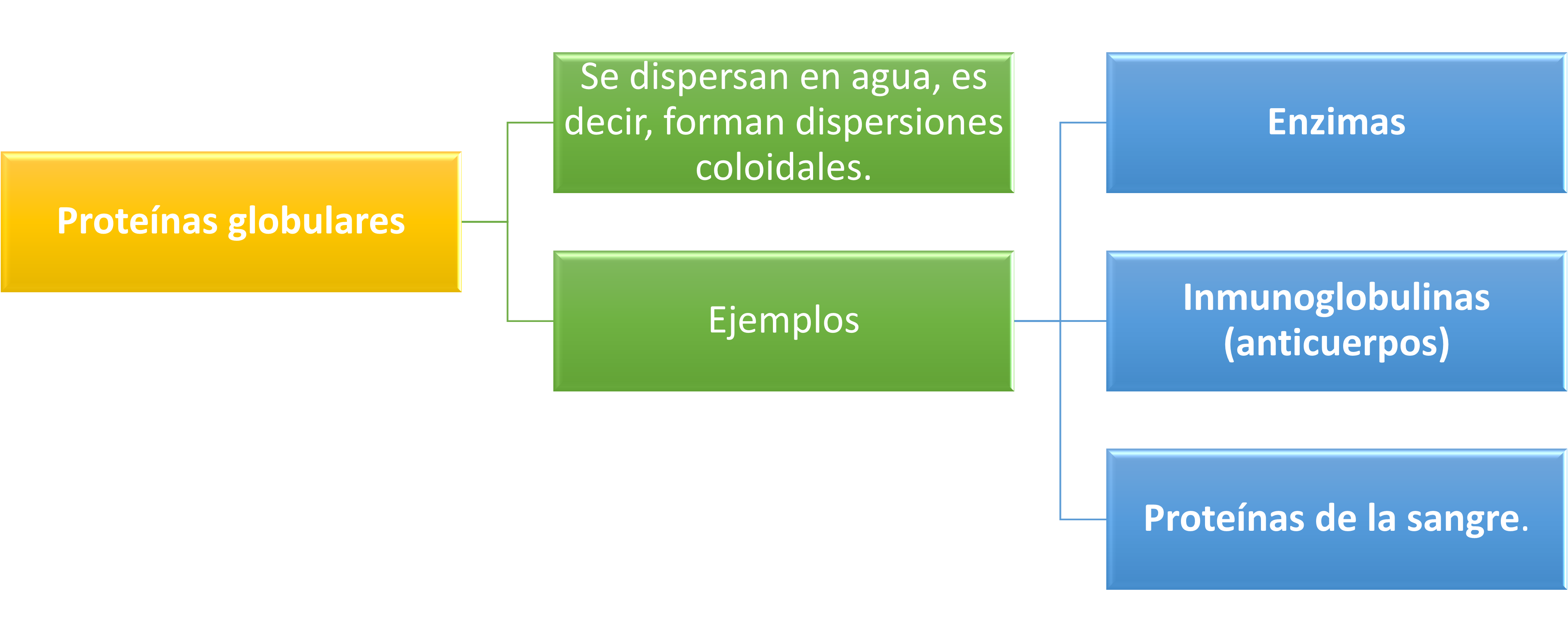
Las albúminas son proteínas globulares que están dispersas en agua y se coagulan al calentarse. Ayudan al transporte de las sustancias hidrofóbicas a través del cuerpo y forman parte de la estructura de las moléculas que transportan los lípidos a través del entorno acuoso de la sangre. Las albúminas también regulan la presión osmótica de la sangre.
Las son un grupo extremadamente importante de proteínas simples. Tanto las enzimas como los anticuerpos están compuestos de globulinas. Se dispersan parcialmente en agua y en soluciones salinas diluidas. Como las albúminas, las globulinas se coagulan fácilmente al calentarse. Muchas globulinas de diferentes tipos se encuentran en la sangre. Estas proteínas de la sangre unen y transportan varias moléculas a través de ella. Otras globulinas de la sangre hacen parte de las (modelo en Mol*) que atacan y neutralizan las proteínas extrañas que entran en el sistema vascular.
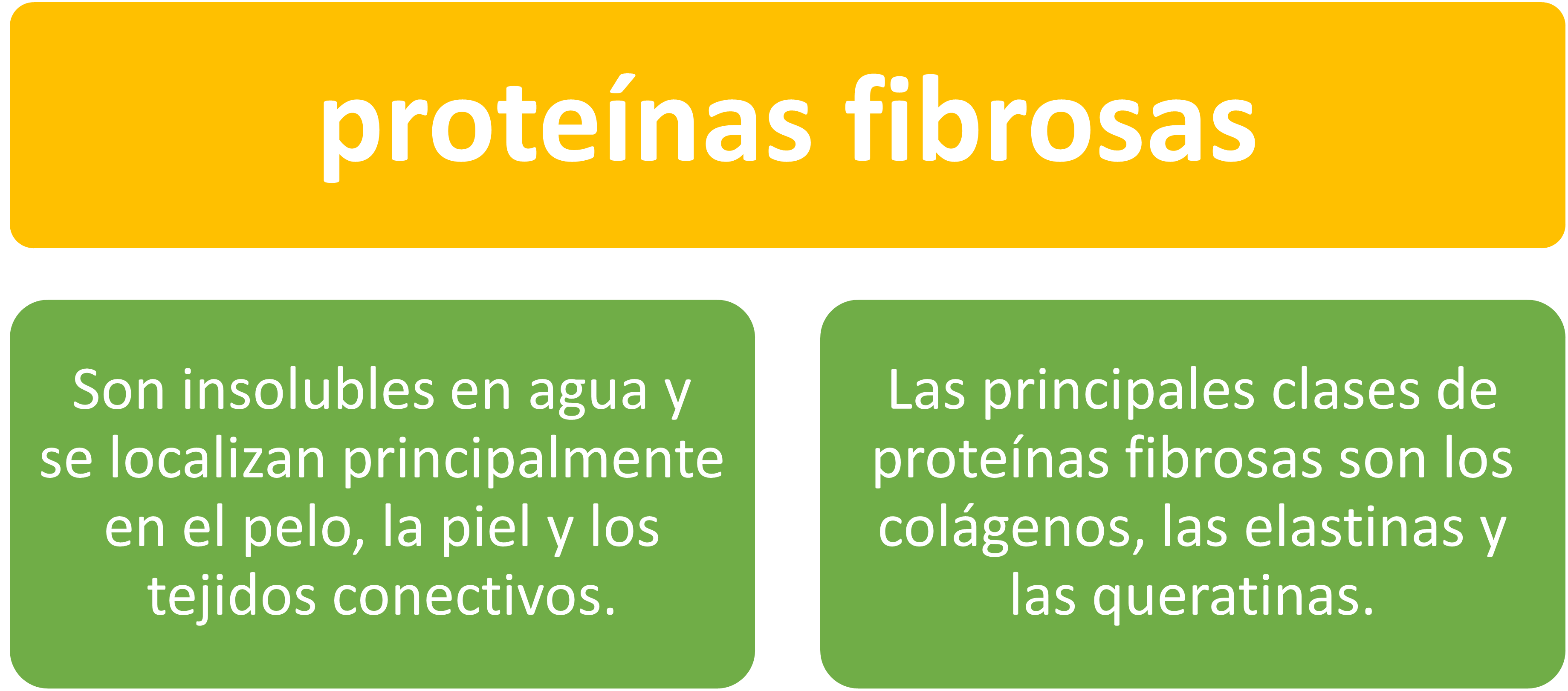
Proteínas Fibrosas
Son insolubles en agua y se localizan principalmente en el pelo, la piel y los tejidos conectivos. Las principales clases de proteínas fibrosas son los colágenos, las elastinas y las queratinas.
Los son la clase más importante de proteínas en los tejidos conectivos y son las proteínas más abundantes en el cuerpo humano. Los colágenos son componentes de los tendones y ligamentos, los huesos y los dientes. Cuando los colágenos se calientan, se hidrolizan a gelatinas de menor masa molecular.
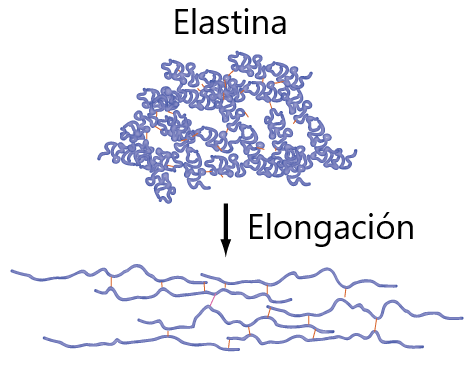
Las elastinas son también componentes del tejido conectivo. Tienen composiciones de aminoácidos similares, pero a la vez diferentes. Comparadas con los colágenos, cuando se calientan no se convierten en gelatinas; son los componentes de las paredes de los vasos sanguíneos. Y como su nombre lo indica, son elásticas y se pueden alargar; esto permite que los vasos sanguíneos se expandan bajo la presión creada por la acción del bombeo de la sangre por parte del corazón.
Las son las proteínas fibrosas que se encuentran en el pelo, la piel, las uñas, las plumas, el algodón y la lana. Las queratinas fueron las primeras proteínas cuya estructura se identificó. La mayoría de las queratinas contienen grandes cantidades de cisteína, el pelo tiene aproximadamente 14% de cisteína.
Criterios Funcionales
Desde un punto de vista funcional se distinguen:
Proteínas Monoméricas: constan de una sola cadena polipeptídica, como la mioglobina.
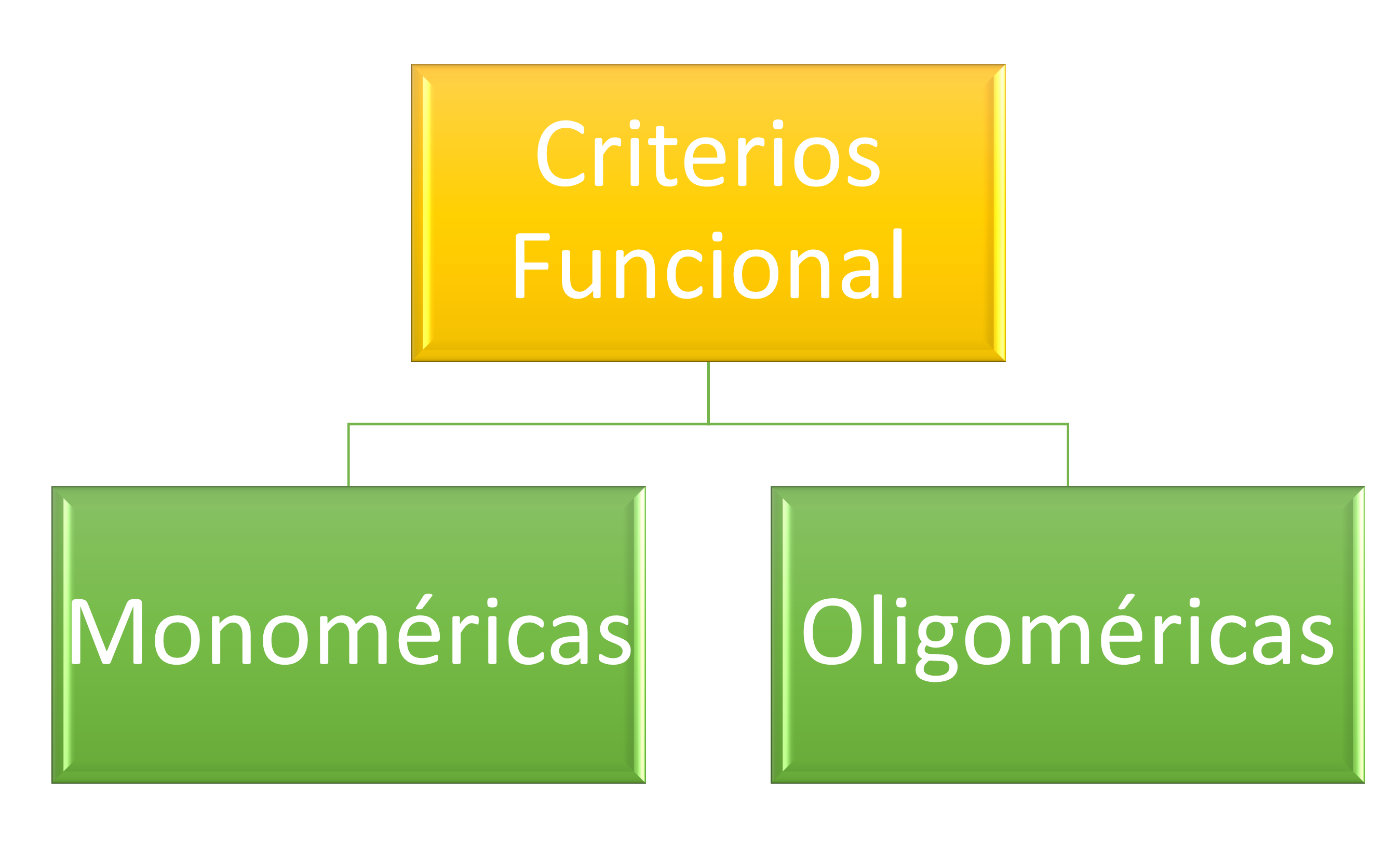
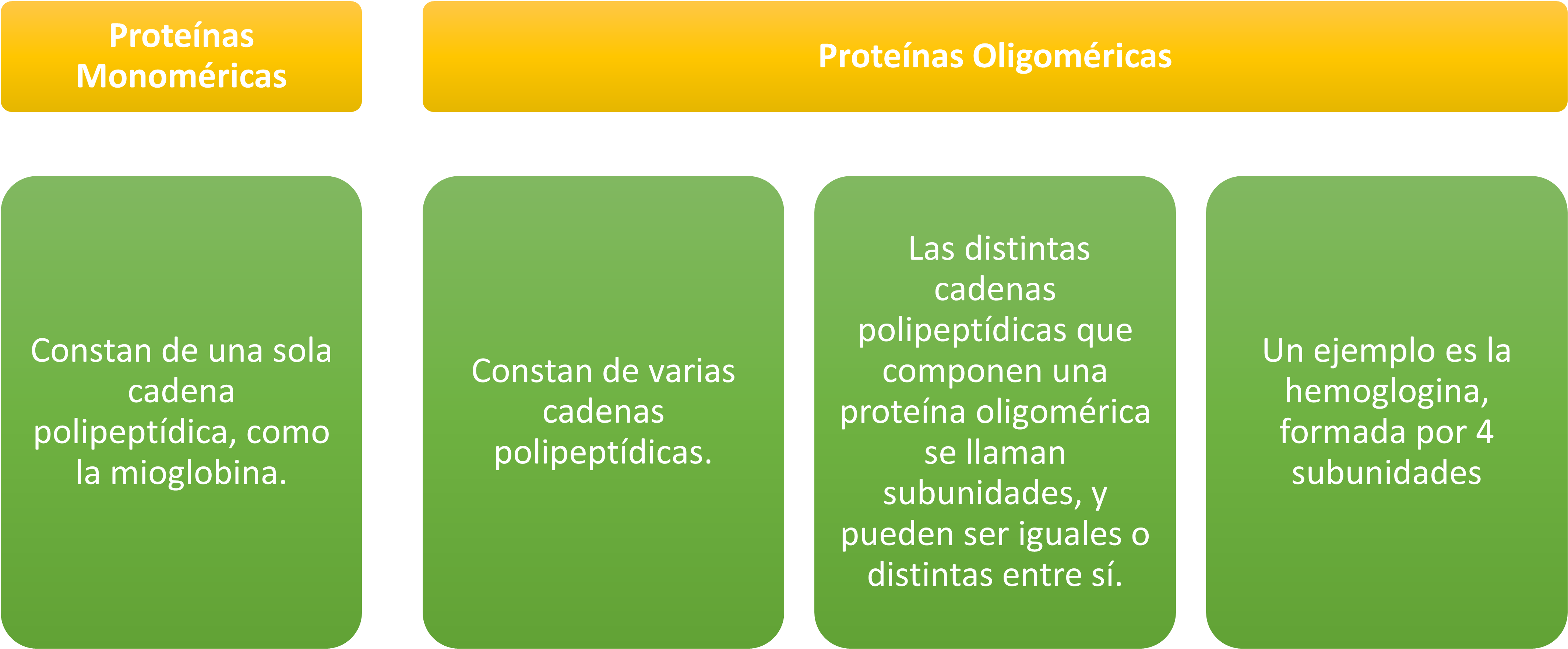
Proteínas Oligoméricas: constan de varias cadenas polipeptídicas. Las distintas cadenas polipeptídicas que componen una proteína oligomérica se llaman subunidades, y pueden ser iguales o distintas entre sí. Un ejemplo es la hemoglobina, formada por 4 subunidades, cada una representada de distinto color en la figura inferior.
Es difícil hacer una clasificación más descriptiva o conceptual. Sin embargo, los criterios que hemos descrito son muy útiles desde el punto de vista práctico, y nos permiten definir al colágeno como una proteína simple, fibrosa y oligomérica, y al citocromo c como una proteína conjugada, globular y monomérica.
Clasificación Estructural extendida de Proteínas (SCOPe)
Actualmente se clasifican las proteínas desde el punto estructural en cuatro grupos principales (todo a, todo ß, a/ß y a+ß) junto con otros tres grupos adicionales. Esta clasificación se recoge en el banco de datos de SCOPe ("Extended Structural Casification Of Proteins").
Prácticamente todas las proteínas presentan similitudes estructurales con otras proteínas y en algunos de los casos esta similitud va acompañada de un origen evolutivo común. la base de datos SCOP proporciona una descripción detallada y comprensiva de las relaciones estructurales y evolutivas entre las estructuras proteicas conocidas.
Esta clasificación de la base de datos de SCOP es jerárquica. Las proteínas se clasifican en familias cuando presentan similitudes de secuencia primaria y/o estructura y función demostrable. Cuando dos o más familias con poco similitud en estructura primaria presentan similitud en estructura y función se agrupan en una superfamilia. Los dos grupos más altos, plegamiento y clase, se basan exclusivamente en aspectos estructurales. En la tabla se muestran los diferentes grupos de la calificación SCOP y se puede visualizar un ejemplo de cada clase.


