Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
- Superficie VDW, la superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.

Compuestos Aromáticos
Formulación de Kekulé
El planteamiento de la estructura del benceno llevó todo un proceso. Inicialmente se propusieron varios modelos como se puede ver a continuación:
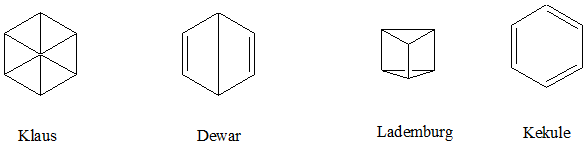
Modelos propuestos
En 1866, sólo unos pocos años después de la publicación de sus ideas acerca de lo que hoy conocemos como teoría estructural de la química orgánica. August Kekulé aplicó sus principios a la estructura del benceno. Basó su razonamiento en tres premisas:
- El benceno es C6H6.
- Todos los hidrógenos del benceno son equivalentes.
- La teoría estructural requiere que haya cuatro enlaces para cada carbono.
Kekulé aventuró la idea de que los seis átomos de carbono del benceno estaban juntos en un anillo. Los cuatro enlaces de cada carbono podían ser acomodados por un sistema de simples y dobles enlaces alternantes con un hidrógeno en cada carbono.
Pronto fue señalado un fallo en la fórmula de Kekulé del benceno. De acuerdo con la fórmula de Kekulé, la disustitución 1,2 es diferente a la disustitución 1,6. Estas dos fórmulas estructurales difieren en que los dos carbonos sustituidos están conectados por un doble enlace en una y por un enlace simple en la otra. Dado que todos los conocimientos disponibles indicaban que tal isomería no existía, Kekulé modificó su hipótesis y consideró que en el benceno existía una rápida migración de enlace consecuencia de una interconversión de dos estructuras.
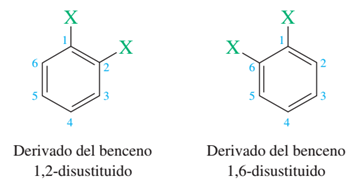
Compuestos "aparentemente" diferentes según Kekulé
Estructuras de Kekulé
La formulación de Kekulé se refiere a la estructura del benceno, pero deja sin resolver importantes preguntas acerca de su reactividad. El benceno no se comporta en la forma que podríamos esperar para el comportamiento del ciclohexatrieno. El benceno no es un ciclohexatrieno estático, el benceno no es un par de isómeros de ciclohexatrieno que se equilibren rápidamente. Quedó para las teorías electrónicas de la química orgánica del siglo XX proporcionar la comprensión acerca del porqué el anillo de benceno es una unidad estructural tan estable.
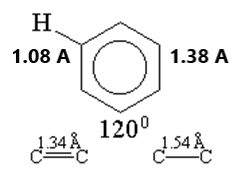
Numerosos estudios no dejan duda de que el benceno es plano y que su esqueleto carbonado tiene la forma de un hexágono regular. No hay evidencias que soporten las formulaciones estructurales con dobles y simples enlaces alternados. Todos los enlaces carbono-carbono tienen la misma longitud (1.39 Å) y los ángulos de enlace de 120° se corresponden perfectamente con la hibridación sp2. Muy interesante es que la distancia de 1.39 Å en el benceno es el punto medio entre la longitud del típico enlace sencillo sp3-sp3 de 1.47 Å y la longitud del doble enlace sp2-sp2 de 1.33 Å. Si las longitudes de enlace están relacionadas con el tipo de enlace, ¿qué tipo de enlace carbono-carbono es el que queda a la mitad entre las longitudes de enlace simple y del doble?
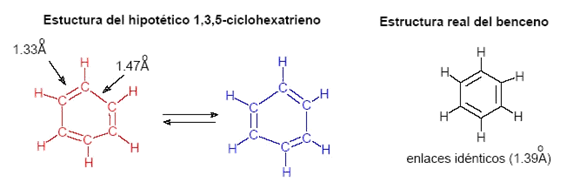
Estructura hipotética
Resonancia del Benceno
La descripción del siglo XX acerca del enlace en el benceno incluyen dos importantes aproximaciones, los tratamientos por resonancia y por orbitales moleculares, que juntos proporcionan un cuadro bastante claro de la aromaticidad. Empezaremos con la descripción de la resonancia.
Híbrido de resonancia
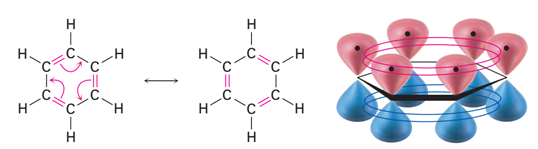
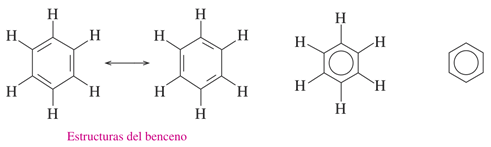
Las dos estructuras de Kekulé para el benceno tienen la misma disposición de los átomos pero difieren en el emplazamiento de los electrones. Así, existen formas resonantes entre sí, pero ninguna de ellas representa correctamente por sí misma el enlace en la molécula real. El benceno es un híbrido de las dos estructuras de Kekulé. La estructura híbrida se representa a menudo por un hexágono que contiene un círculo en la parte interna. El círculo nos recuerda la naturaleza deslocalizada de los electrones. fue sugerida por primera vez por el químico Robert Robinson como un símbolo conveniente para el sexteto aromático, los seis electrones pi deslocalizados en el anillo de benceno.
Orbitales moleculares π del benceno
Después de haber visto al benceno con base en la resonancia, se verá ahora una descripción basada en los orbitales moleculares. La teoría OM describe al benceno de un modo que, en muchos aspectos, es superior a la aproximación simple de la resonancia.
En la representación orbital se ponen de relieve la conjugación cíclica de la molécula de benceno y la equivalencia de los seis enlaces carbono-carbono.
Dado que los seis átomos de carbono y los seis orbitales p del benceno son equivalentes, es imposible definir tres enlaces πi de alqueno localizados en los cuales un orbital π dado se superponga sólo con un orbital p vecino. Más bien, cada orbital p se superpone de igual manera con ambos orbitales p vecinos, lo que da por resultado un esquema del benceno en el que los seis electrones π se encuentran completamente deslocalizados alrededor del anillo. El benceno tiene, por tanto, dos nubes de electrones en forma de rosquilla, una por encima del anillo y otra por debajo.
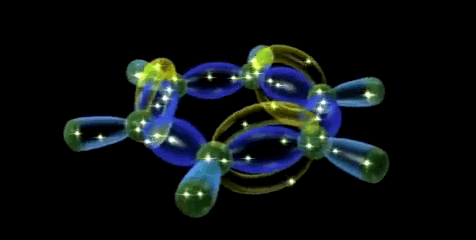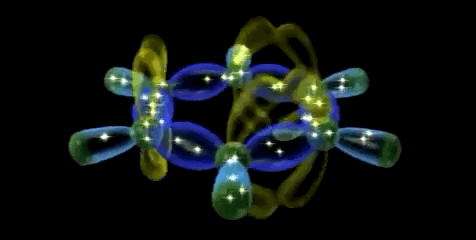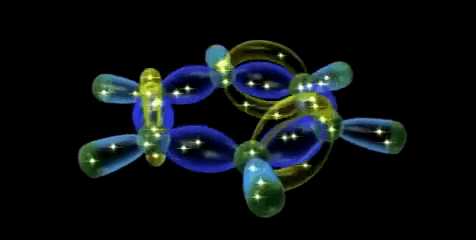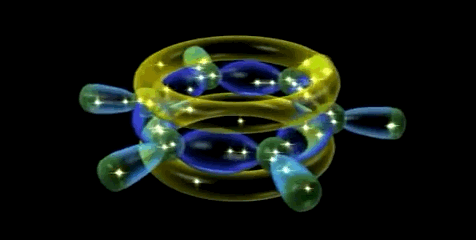
Simulador de la hibridación sp2 aromática (orbital molecular π gigante)
A continuación se puede observar las imágenes que se obtienen con el simulador de la hibridación sp2.
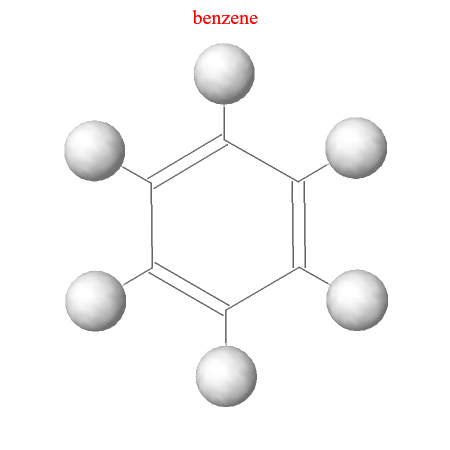
Orbital 1s del hidrógeno
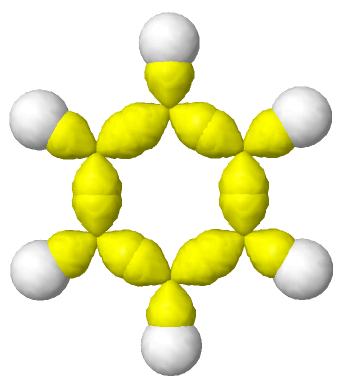
Orbitales sp2

Orbitals p (lóbulos rojo y azul)
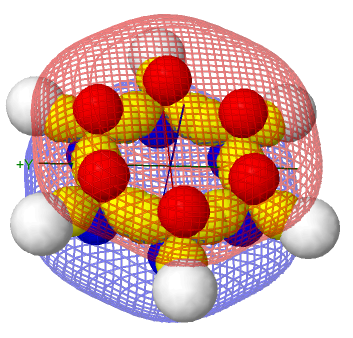
Orbital molecular π gigante
¡Atención!
Simulador del orbital molecular π gigante
La longitud de todos los enlaces C-C en el benceno es intermedia entre un enlace simple y uno doble y tiene un valor de 1.38 Angstroms. La distancia de todos los enlaces C-H es de 1.08 angstroms. Todos los ángulos de enlace son de 120o.