Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
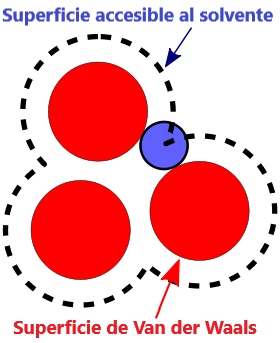
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Cargas parciales, para ver el valor de la carga relativa positiva o negativa de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Ácidos y Bases
Ácidos, Bases y Sales
Los ácidos, bases y sales están entre los solutos más comunes e importantes encontrados en solución. Estas sustancias fueron caracterizadas hasta finales del siglo XIX en cuanto a sus propiedades como sabor y por el cambio de color que inducen en ciertos colorantes. Los ácidos tienen un sabor agrio; las bases amargo; y las sales, salado. El tornasol, un colorante, se torna rojo en la presencia de un ácido y azul en la presencia de bases. Estas y otras observaciones llevaron a la correcta de que los ácidos y las bases son opuestos químicamente, y que las sales son producidas cuando un ácido reacciona con una base. Ahora, los ácidos y las bases son definidos en una forma más precisa que son muy útiles cuando se estudia sus características.
Teoría de Ácidos y Bases de Svante August Arrhenius
Unos de los primeros que definió a los ácidos y las bases desde el punto de vista químico fue Svante August Arrhenius (1859-1927) quien investigó las propiedades conductoras de las disoluciones electrolíticas (que conducen carga). Formuló la teoría de la disociación electrolítica definiendo los ácidos como sustancias químicas que contenían hidrógeno que disueltas en agua producían una concentración de iones hidrógeno o protones, mayor que la existente en el agua pura. Del mismo modo, Arrhenius definió una base como una sustancia que disuelta en agua producía un exceso de iones hidroxilo, OH-. La reacción de neutralización sería:

Reacción de Neutralización

Ácido
Ácidos Fuertes y Débiles
Los ácidos fuertes son aquellos que se ionizan totalmente —o casi totalmente— en agua.

Ácidos fuertes y débiles
En soluciones diluidas, el ácido clorhídrico dona su protón al agua para formar iones hidronio H3O+.

La ionización del ácido se puede simplificar a la siguiente ecuación:

y otros son considerados como ácidos débiles como el ácido acético que se ioniza un porcentaje muy bajo (menor del 5%) y que, al estar en solución acuosa, va a producir un equilibrio entre los iones y la fórmula molecular, como se observa a continuación:


Algunos ácidos comunes
 |
 |
|---|
A continuación puede ver un simulador de ácidos fuertes y débiles: ... Hacer clic aquí
Bases Fuertes y Débiles
En la vida cotidiana se utilizan algunas bases caseras, algunas fuerte y otras débiles, para diferentes situaciones como por ejemplo, tomar antiácidos para disminuir la acidez estomacal, destapar tuberías, limpiar hornos, etc.
El hidróxido de sodio es una base fuerte porque se ioniza completamente o casi completamente:

El amoníaco es una base débil porque no se ioniza completamente en el agua:


Algunas bases comunes
 |
 |
|---|