Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
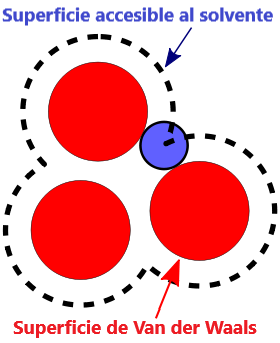
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Cargas parciales, para ver el valor de la carga relativa positiva o negativa de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Solución Reguladoras
Una solución reguladora que se usa bastante en los laboratorios de química esta constituida por ácido acético (ácido débil) y acetato de sodio (sal o base conjugada) Esta solución reguladora se considera ácida. Si se agregan cantidades iguales de ácido acético y acetato de sodio, se produce una solución reguladora que tiene un pH de 4.7.
Tal como se indicó en la introducción, el equilibrio que se produce es el siguiente:
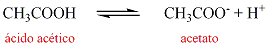
Problema 1
Un ejemplo concreto de esta solución reguladora podría contener 0.1 mol/litro de ácido acético y 0.1 mol/litro de acetato de sodio (... ver animación). Para encontrar el pH de esta solución realizamos los siguientes cálculos partiendo del valor teórico de la constante de ionización del ácido acético que es 1.8x10-5:

Del ejemplo anterior, se puede generalizar diciendo que para cualquier solución reguladora, la concentración de ion hidrógeno o del ion hidroxilo es igual a:

Problema 2
A la solución reguladora de ácido acético-acetato del problema 1 que tiene un pH de 4.74, se le puede agregar una cantidad de NaOH (... ver animación) que haría la solución 0.02 M en NaOH si la solución reguladora no estuviera presente. Calcular el nuevo pH.
En principio, al agregar una solución de base fuerte (NaOH), esta reacciona con el ácido acético que constituye la solución reguladora. La reacción que se lleva a cabo disminuye la concentración de ácido acético y aumenta la concentración de acetato de sodio:

En vista de lo anterior, hay que modificar la ecuación ya que se consume la concentración de ácido acético (indicado con el signo negativo) y aumenta la concentración de ion acetato (indicado con signo positivo):

Observe que la variación de pH entre el problema 2 (ph=4.92) y problema 1 (pH=4.74) es prácticamente insignificante.
Problema 3 (problema simplificado
A la misma solución reguladora del problema 1 se le agrega una cantidad de HCl (... ver animación) que haría que la solución fuera 0.02 M si la solución reguladora no estuviera presente.
En principio, al agregar una solución de ácido fuerte (HCl), este reacciona con la base que es el acetato disminuyendo su concentración y aumentando la concentración de ácido:

Simulador de Ácido Acético-Acetato
Problema 4
Un amortiguador de acetato contiene 0.1 M de ácido acético y 0.1 M de acetato de sodio. Calcular el pH de la solución amortiguadora después de agregar 5 mL de ácido clorhídrico 0.05 M a 10 mL de la solución anterior.
El primer paso es calcular la concentración final del HCl al mezclarse con la solución amortiguadora.
El ácido clorhídrico reacciona con el acetato de sodio para formar ácido acético. Por lo tanto, la concentración de acetato de sodio disminuye en 0.017 M y la concentración de ácido acético aumenta en la misma cantidad:
