Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
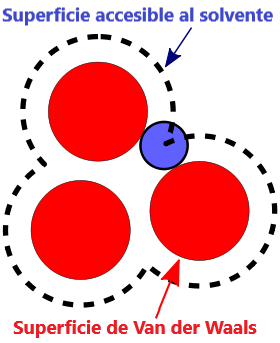
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Cargas parciales, para ver el valor de la carga relativa positiva o negativa de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Reacciones Redox
Balanceo o ajuste por el método del número de oxidación
El método de balanceo de ecuaciones por el número de oxidación es el más utilizado para balancear ecuaciones moleculares.
Ejemplo No. 1
Balancear la siguiente reacción química:

Para aplicar este método se pueden seguir los siguientes pasos:
- Determinar el número de oxidación de cada uno de los elementos de todos los compuestos, escribiendo en la parte superior del símbolo de cada elemento, su correspondiente valor
- Ya establecidos los números de oxidación, observe detenidamente qué elemento se oxida y cuál se reduce
- El hidrógeno se reduce, ya que pasa de un número de oxidación de +1 a 0. Esto debe interpretarse como que el hidrógeno gana un electrón. Sin embargo, al haber 2 hidrógenos en ambos lados de la ecuación, este valor debe multiplicarse por 2.
- Observe que el oxígeno se oxida, ya que pasa de un número de oxidación de -2 a 0. Esto quiere decir que el oxígeno pierde dos electrones. Del lado derecho de la ecuación, aparece el oxígeno en su estado fundamental (O2) como molécula diatómica, por lo que es necesario multiplicar por 2.
- Anote en la parte inferior de la molécula de hidrógeno, el número de electrones ganados en la reducción. Haga lo mismo para la molécula de oxígeno, anotando el número de electrones perdidos en la oxidación:
- Estos dos valores obtenidos, serán los primeros dos coeficientes, pero cruzados. El 4 será el coeficiente del hidrógeno y el 2 el coeficiente del oxígeno:
- El resto de sustancias se balancean por tanteo, en este caso, poniendo un coeficiente 4 al agua:
- Finalmente, de ser posible, se debe simplificara los números enteros más pequeños:





Para finalizar este primer ejemplo, es conveniente revisar las siguientes definiciones:
Agente Oxidante: es la sustancia que contiene el elemento que se reduce.
Agente reductor: es la sustancia que contiene el elemento que se oxida.
Tanto el agente oxidante como el agente reductor deben ser analizados en el lado de los reactivos. En el ejemplo anterior, podemos observar que el agua actúa tanto de agente oxidante porque contiene al H que se reduce, y como agente reductor porque contiene al oxígeno que se oxida.
Electrones transferidos: En todo proceso redox el número de electrones transferidos es igual al número de electrones perdidos en la oxidación e igual al número de electrones ganados en la reducción.
e- transferidos = e- perdidos en oxidación = e- ganados en reducción
e- transferidos = 4e- = 4e-
¡Atención!
Electrones perdidos y ganados
Los electrones perdidos en la oxidación son 4 porque son dos oxígenos que pierden 2 electrones cada uno.
Los electrones ganados en la reducción también son 4 porque son 4 hidrógenos que ganan un electrón cada uno.
Ejemplo No. 2
Balancear la siguiente reacción química:

Nuevamente, podemos seguir los siguientes pasos:
- Determinar el número de oxidación de cada uno de los elementos de todos los compuestos, escribiendo en la parte superior del símbolo de cada elemento, su correspondiente valor
- Ya establecidos los números de oxidación, observe detenidamente qué elemento se oxida y cuál se reduce.
- El estaño se reduce, ya que pasa de un número de oxidación de +4 a +3 ganando un electrón.
- Observe que el nitrógeno se oxida, ya que pasa de un número de oxidación de -3 a 0. Esto quiere decir que el nitrógeno pierde tres electrones. Del lado derecho de la ecuación aparece el nitrógeno en su estado fundamental (N2) como molécula diatómica, por lo que es necesario multiplicar por 2.
- Anote en la parte inferior de la molécula de hidrógeno, el número de electrones ganados en la reducción. Haga lo mismo para la molécula de oxígeno, anotando el número de electrones perdidos en la oxidación:
- Estos dos valores obtenidos, serán los primeros dos coeficientes, pero cruzados. El 6 será el coeficiente del cloruro de estaño (III) y el 1 el coeficiente del nitrógeno:
- El resto de sustancias se balancean por tanteo:
- Esta ecuación ya no se puede simplificar.




Para finalizar este segundo ejemplo, es conveniente revisar las siguientes definiciones:
Agente Oxidante: es la sustancia que contiene el elemento que se reduce: SnCl4
Agente reductor: es la sustancia que contiene el elemento que se oxida: NH3
Electrones transferidos:
e- transferidos = e- perdidos en oxidación = e- ganados en reducción
e- transferidos = 6e- = 6e-
¡Atención!
Electrones transferidos
Los electrones perdidos en la oxidación son 6 porque son dos nitrógenos que pierden 3 electrones cada uno.
Los electrones ganados en la reducción también son 6 porque son 4 estaños que ganan un electrón cada uno.