Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
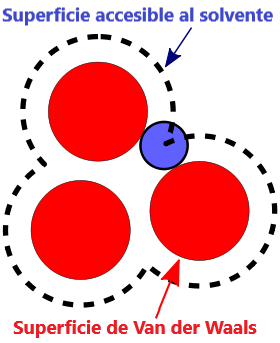
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Cargas parciales, para ver el valor de la carga relativa positiva o negativa de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Reacciones Redox
Para comprender las reacciones de oxidación y de reducción es necesario definir inicialmente el término de número de oxidación.
¡Atención!
Número de Oxidación
El número de oxidación es un número entero positivo o negativo que es utilizado para describir la capacidad de combinación de un elemento en un compuesto.
Existen números de oxidación fraccionarios en los átomos de los compuestos, pero no son comunes en los compuestos inorgánicos. Un ejemplo es el Na2S4O6 (tetrationato de sodio), el cual el átomo de azufre tiene un número de oxidación promedio igual a 2½.
La variación en el número de oxidación de un átomo antes de llevarse a cabo la reacción química y después de realizada, manifiesta la cantidad de electrones ganados o perdidos. Un cambio positivo se lleva a cabo cuando un átomo pasa del estado libre o no combinado en el que el número de oxidación es igual a cero, a un estado combinado en el que el número de oxidación es positivo. Un ejemplo de un cambio negativo puede ser el caso en el que un átomo pasa de un estado no combinado a un estado combinado con número de oxidación negativo.
Desde hace mucho tiempo se utilizó el término oxidación para los casos en los que un elemento se combinaba con oxígeno, pero en la actualidad, el término se ha generalizado mucho más, definiéndose oxidación como el cambio químico en el que se pierde electrones produciéndose un aumento en el número de oxidación.
La reducción es un cambio química en el que un átomo gana electrones produciéndose una disminución en el número o estado de oxidación.
¡Atención!
Número de Oxidación
Número de oxidación es un número entero positivo o negativo que se utiliza para describir la capacidad de combinación de un elemento en un compuesto.
Oxidación: Proceso que se lleva a cabo cuando una sustancia se combina con oxígeno, o todo proceso en el que hay pérdida de electrones. Se produce un aumento en el número de oxidación.
Reducción: Proceso que se lleva a cabo cuando una sustancia libera oxígeno, o todo proceso químico en el que hay una ganancia de electrones. Se produce una disminución en el número de oxidación.
En una reacción, cualquiera que sea la sustancia que se oxida, pierde electrones y otra sustancia los gana, la que a su vez se reduce; por lo tanto la oxidación acompaña a la reducción y la reducción acompaña a la oxidación. La ecuación se llama entonces de oxidación-reducción (o ecuación "redox").
En una ecuación de redox, a la sustancia que se oxida se le conoce con el nombre de agente reductor porque produce la reducción de otra sustancia. A la sustancia que se reduce se le llama agente oxidante, ya que por el contrario, produce la oxidación de otra sustancia.
Un ejemplo de lo expuesto anteriormente puede ser la siguiente reacción:

El Zn sufre una oxidación ya que pierde 2 e- por lo que se produce el ion Zn+2. Esto también causa que aumente su estado de oxidación de 0 a +2.

Ahora bien, al azufre le ocurre el proceso inverso, es decir la reducción, ya que pasa de un estado de oxidación de o a -2.

Finalmente, para visualizar de mejor forma los cambios que han ocurrido al Zn y al S, esto se puede indicar de la siguiente manera:

El Zn es el agente reductor y el azufre el agente oxidante.
Reacciones de oxidación y reducción
Los procesos de oxidación y reducción se ven comúnmente en términos de ganancia o pérdida de electrones o aumento o disminución de los números de oxidación. Sin embargo, muchas reacciones en química orgánica que implican la ganancia o pérdida de oxígeno o hidrógeno también se consideran reacciones redox.
| Oxidación | Reducción |
|---|---|
| Pérdida completa de electrones (reacción iónica) | Ganancia completa de electrones (reacción iónica) |
| Aumento en el número de oxidación | Disminución del número de oxidación |
| Ganancia de oxígeno | Pérdida de oxígeno |
| Pérdida de hidrógeno en un compuesto molecular | Ganancia de hidrógeno en un compuesto molecular |
Oxidación es ganancia de oxígeno. Reducción es pérdida de oxígeno
La oxidación y la reducción también se pueden definir en términos de cambios en la composición. El significado original de oxidación era "agregar oxígeno", por lo que cuando se agrega oxígeno a una molécula, la molécula se oxida. Lo contrario es cierto para la reducción: si una molécula pierde átomos de oxígeno, la molécula se reduce. Por ejemplo, la molécula de acetaldehído (CH3CHO) toma un átomo de oxígeno para convertirse en ácido acético (CH3COOH).
CH3CHO → CH3COOH
El acetaldehído se oxidó.
La oxidación es pérdida de hidrógeno en un compuesto molecular. Reducción es ganancia de hidrógeno en un compuesto molecular
La oxidación y la reducción se pueden definir en términos de ganancia o pérdida de átomos de hidrógeno. Si una molécula agrega átomos de hidrógeno, se está reduciendo. Si una molécula pierde átomos de hidrógeno, la molécula se oxida. Por ejemplo, en la conversión de acetaldehído en etanol CH3CHO, se agregan átomos de hidrógeno al acetaldehído, por lo que el acetaldehído se reduce:
CH3CHO + H2 → CH3CH2OH
El acetaldehído se redujo.