Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
- Superficie VDW, la superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.

Carbohidratos
Estereoisomería
Debido a que todos los carbohidratos tienen átomos de carbono quirales, desde tiempo atrás se reconoció que es necesario un método estándar de representación para describir la estereoquímica de los carbohidratos. El método más difundido emplea las proyecciones de Fischer para describir los centros de quiralidad sobre una página plana.
Estereoisómeros posibles según el número de carbonos quirales

Recuerde que un átomo de carbono tetraédrico se representa en una proyección de Fischer con dos líneas cruzadas. Las líneas horizontales representan los enlaces que salen de la página, y las líneas verticales, los enlaces que están dentro de la misma página. Por convención, el carbono se coloca en o cerca de la parte superior en las proyecciones de Fischer. Así, el (R)-gliceraldehído (D-gliceraldehído), el monosacárido más sencillo se representa de la siguientes forma:
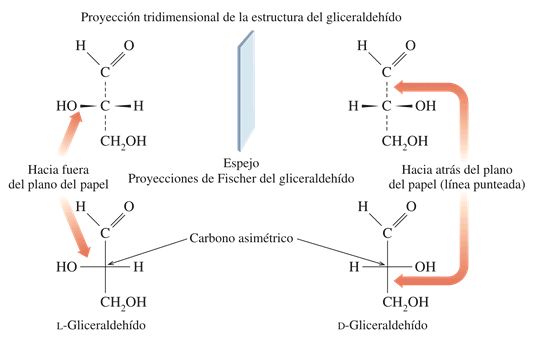


El gliceraldehído, la aldosa más sencilla, sólo tiene un centro de quiralidad, de suerte que posee dos formas enantiómeras (imágenes especulares). Sin embargo, sólo el enantiómero dextrorrotatorio se encuentra en forma natural; esto es, una muestra del gliceraldehído que se encuentra en la naturaleza en un polarímetro hace girar la luz polarizada en un plano en la dirección de las manecillas del reloj (+).
Dado que se ha demostrado que el (+)-gliceraldehído tiene una configuración R en C2, y por razones históricas anteriores a la adopción del sistema R, S, nos referimos al (R)-(+)-gliceraldehído como D-gliceraldehído (D porque es dextrorrotatorio). El otro enantiómero, (S)-(-)-gliceraldehído se conoce como (L)-gliceraldehído (L por levorrotatorio, o levogiratorio).
Debido a la forma en que los monosacáridos se biosintetizan en la naturaleza, la glucosa, la fructosa y casi todos los monosacáridos que se encuentran en la naturaleza tienen la misma configuración estereoquímica R que el D-gliceraldehído en el centro de quiralidad más alejado del grupo carbonilo. En las proyecciones de Fischer, la mayor parte de los azúcares naturales tiene el grupo hidroxilo en el centro inferior de quiralidad a la derecha. Nos referimos a todos estos azúcares como azúcares D.

En contraste con los azúcares-D los azúcares-L tienen una configuración S en el centro de quiralidad inferior, con el grupo -OH apuntando hacia la izquierda en las proyecciones de Fischer. Así, un azúcar L es la imagen especular (enantiómero) del azúcar D correspondiente y tiene la configuración opuesta a dicho azúcar en todos los centros de quiralidad. Observe que las notaciones D y L no tienen relación con la dirección en que un azúcar dado hace rotar la luz polarizada en un plano; un azúcar D puede ser dextrorrotatorio o levorrotatorio. El prefijo D indica solamente que el grupo -OH en el centro de quiralidad más bajo esta a la derecha cuando la molécula se dibuja en una proyección de Fischer, con el grupo carbonilo en la parte superior o cerca de ella.

Note también que en el sistema de nomenclatura D o L de carbohidratos sólo se describe la configuración de un centro de quiralidad y no se dice nada respecto a la configuración de otros posibles centros de quiralidad. La ventaja del sistema es que permite relacionar un azúcar con otro con rapidez y visualmente.
Las aldotetrosas son azúcares de cuatro carbonos con dos centros de quiralidad. Hay 22 = 4 posibles aldotetrosas estereoisómeras, o dos pares de enantiómeros D, L, llamados eritrosa y tetrosa.
- Estructura de Fischer de la

- Estructura de Fischer de la L-eritrosa.

Las aldopentosas tienen tr es centros de quiralidad y un total de dos elevado al cubo -8- posibles estereoisómeros, o cuatro pares D, L de enantiómeros. Estos cuatro pares se llaman ribosa, arabinosa, xilosa y lixosa. Todos excepto la lixosa, se encuentran en abundancia en la naturaleza. La es un constituyente importante del ARN (ácido ribonucleico), la con sólo dos centros quirales es constituyente del ADN, la L-arabinosa se encuentra en las plantas y la xilosa en la madera.


Las aldohexosas tienen cuatro centros de quiralidad y un total de dos a la cuarta potencia -16- posibles estereoisómeros, u ocho pares de enantiómeros D, L. Los nombres son alosa, altrosa, glucosa, manosa, gulosa, idosa, galactosa y talosa. De las ocho sólo la D-glucosa (del almidón y la celulosa) y la D-galactosa (de gomas y pectinas) sen encuentran ampliamente en la naturaleza. La D-manosa y la D-talosa también se encuentran en la naturaleza, pero en menor abundancia.



Epímeros
Los epímeros se diferencian en un sólo carbono asimétrico-
- la D-Manosa es el
2-epímero de la D-Glucosa
- La D-Galactosa es
4-epímero de la D-Glucosa
L-Fucosa
La fucosa (FUC) es uno de los ocho glúcido monosacáridos esenciales para el correcto funcionamiento de muchos organismos vivos entre ellos los seres humanos. Es una aldohexosa parecida a la galactosa pero se diferencia de ésta por la presencia de un grupo metilo en el carbono 5 en lugar de tener un hidroximetil por lo que se considera como una desoxialdohexosa.
Este glúcido lo podemos encontrar en importante presencia en fruta y miel.
En nuestro organismo la fucosa se encuentra en 4 lugares específicos: cruce entre nervios, en el riñón, testículos y la capa externa de la piel. Tiene dos formas:
- : forma sintética de la fucosa.
- : forma natural de la fucosa.
