Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
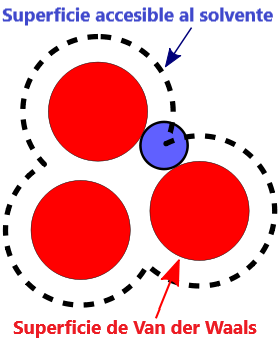
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Estequiometría
Video con Descarga Progresiva Optimizada
Conversiones Químicas Teoría, Ejemplos y Calculadora Profesional
¿Qué es el Mol?
El mol es la unidad base para medir la cantidad de sustancia. Se utiliza para cuantificar entidades elementales como átomos, moléculas o iones.
- 1 Mol = 6.022 × 1023 partículas.

El Número de Avogadro (NA)
Es la constante que relaciona los moles con el número de partículas. Es el puente entre lo macroscópico (gramos) y lo microscópico (átomos).

Masa Molar (MM)
Es la masa de un mol de una sustancia (g/mol). Numéricamente igual al peso atómico en uma de la tabla periódica, pero expresado en gramos.
Para convertir unidades, se multiplica por fracciones equivalentes a 1. La unidad a cancelar va en el denominador.
A. Conversiones Básicas
Moles en 54.0 g de H2O. (MM = 18.0 g/mol)
Moléculas en 2.50 moles de CO2.
Átomos en 10.0 g de Oro (Au). (MM = 197.0 g/mol)
B. Conversiones Inversas
Moles en 3.01 × 1023 átomos de Fe.
Gramos en 2.00 moles de NaCl (MM = 58.44 g/mol).
Masa de 1.20 × 1024 moléculas de CH4 (MM = 16.04 g/mol).
C. Estequiometría (Elemento en Compuesto)
Moles de H en 2.00 moles de Amoniaco (NH3).
Gramos de O en 50.0 g de CO2 (MM = 44.01 g/mol).
mmol de NH3 en 500 mg de N. (MM N = 14.01 g/mol).
El concepto de mol y el número de Avogadro son pilares fundamentales no solo en la teoría química, sino en aplicaciones prácticas vitales.
En la Enseñanza de la Química
El mol actúa como el puente conceptual indispensable entre el mundo microscópico (átomos y moléculas invisibles) y el mundo macroscópico (gramos y litros que podemos medir). Sin este concepto, sería imposible entender cómo las reacciones químicas ocurren a nivel de partículas y cómo calcular las cantidades necesarias para una reacción en el laboratorio.
En las Ciencias Médicas
En medicina y farmacología, la precisión es vida. El uso del mol permite:
- Dosificación de Medicamentos: Calcular con exactitud la cantidad de moléculas activas en un fármaco para asegurar su eficacia terapéutica sin llegar a la toxicidad.
- Análisis Clínicos: Los resultados de laboratorio (como glucosa, colesterol o electrolitos) se reportan frecuentemente en moles por litro (mol/L) o milimoles (mmol/L), lo que proporciona una medida estandarizada de la concentración de sustancias en la sangre, independiente de su peso molecular.
Intente resolver estos ejercicios y verifique sus respuestas con la Calculadora Universal (abajo).
- Moles de Hidróxido de Calcio: Calcular los moles en 148.2 g de Ca(OH)2.
- Masa de Sulfato de Amonio: Calcular la masa en gramos de 0.500 moles de (NH4)2SO4.
- Partículas de Agua: Calcular cuántas moléculas hay en 5.00 g de H2O.
- Partículas a Moles: Calcular los moles presentes en 1.204 × 1024 moléculas de NH3.
- Masa de Elemento: Calcular los gramos de Nitrógeno (N) contenidos en 100.0 g de (NH4)2CO3.
- Milimoles: Calcular los milimoles (mmol) de KMnO4 presentes en 500 mg de sustancia.