Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
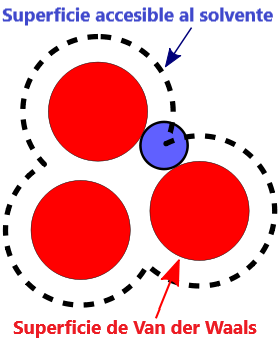
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Estequiometría

Escuchar Podcast
Haz clic en el botón para cargar y reproducir el audio.
¿Por qué tantas preguntas? (Estrategia Socrática)
Quizás notes que en esta página te hacemos muchas preguntas en lugar de solo darte fórmulas. A esto le llamamos Estrategia Socrática.
Consiste en guiarte para que tú mismo descubras las respuestas usando tu lógica y conocimientos previos (como preparar un sándwich), en lugar de memorizar pasos mecánicamente. Queremos que "conectes los puntos" por ti mismo, porque lo que se descubre, ¡no se olvida!
El Concepto (La Receta)
Imagina que estás en la cocina y quieres preparar un sándwich de jamón. Tienes una "receta" muy clara en tu cabeza:

Aquí, el pan y el jamón son tus ingredientes (reactivos) y el sándwich es tu platillo final (producto). La receta te da una regla de oro: por cada 1 sándwich que quieras, necesitas obligatoriamente 2 rebanadas de pan. No es una sugerencia, es una proporción exacta.
En química, las ecuaciones balanceadas son exactamente eso: recetas.
Los coeficientes (los números grandes al principio) no son solo números; son las instrucciones de la receta que te dicen cuántas partes de cada ingrediente necesitas para cocinar tus productos químicos.
El Mapa (Tu Herramienta de Navegación)
Video con Descarga Progresiva Optimizada
Ahora que entendemos que la ecuación es una receta, necesitamos una herramienta para usarla. Esa herramienta es el Método de la Relación Molar.
Volvamos a nuestra receta química del agua:
Esta receta nos permite crear herramientas de conversión. Piensa en ellas como "utensilios" de cocina. Dependiendo de qué ingrediente tengas y qué quieras obtener, usarás un utensilio diferente. Aquí están tus 6 herramientas para esta receta:
¿Cómo se usan? Imagina que te preguntan: "Si tengo mucho oxígeno (O2), ¿cuánto hidrógeno (H2) necesito?".
Buscas la herramienta que tenga "lo que quiero" (H2) arriba y "lo que tengo" (O2) abajo. ¡Es como elegir el cuchillo correcto para cortar!
Este método es el corazón de la estequiometría: usar la receta para convertir lo que tienes en lo que necesitas.
Observemos la receta para quemar :
Esta receta nos dice que 1 mol de propano requiere 5 moles de oxígeno para cocinar 3 moles de dióxido de carbono y 4 moles de agua. Con esto, podemos responder cualquier pregunta de "cuánto necesito" o "cuánto produzco".
Tu Mapa de Ruta
Para no perderte en los cálculos, usa este mapa. Te dice exactamente qué pasos seguir dependiendo de dónde empieces (gramos o moles) y a dónde quieras llegar.
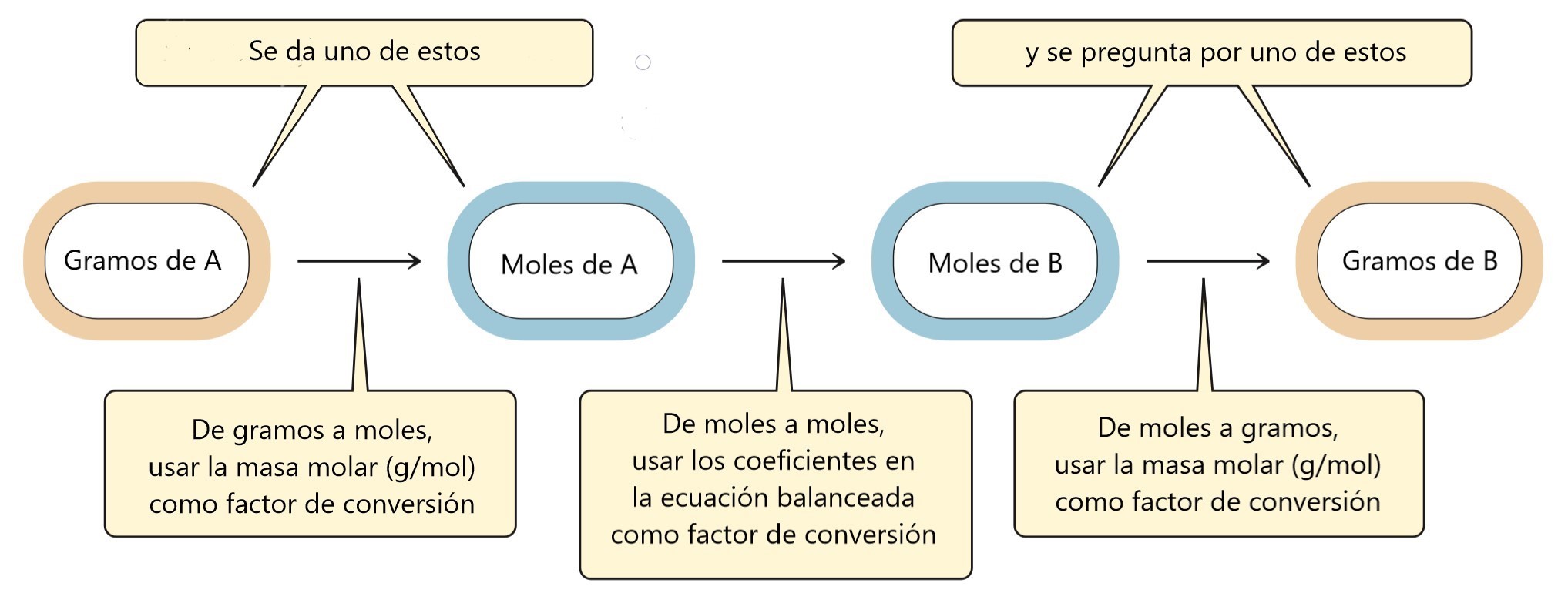
El paso central, el puente, siempre es la relación molar (la receta). Si te dan gramos, primero debes convertirlos a moles para poder "entrar" a la receta.
Guía de Estudio: El Mapa Molar
Exploración (Práctica Guiada)
Ejemplo 1: Producción de Amoníaco
El amoníaco se produce a escala industrial por la reacción entre nitrógeno gaseoso (proceso Haber) de acuerdo con la siguiente ecuación balanceada:
¿Cuántos gramos de N2 son necesarios para producir 7.50 g de ?
Estrategia Socrática
En lugar de darte la respuesta, pensemos juntos:
- ¿Dónde estamos? (Punto de Partida): El problema nos da 7.50 g de NH3. Estamos en "Gramos de Producto".
- ¿A dónde vamos? (Destino): Nos piden gramos de N2. Queremos llegar a "Gramos de Reactivo".
- ¿Cuál es el puente? (La Receta): La ecuación dice que 1 mol de N2 produce 2 moles de NH3. Pero la receta habla en moles, no en gramos.
- Plan de Viaje:
- Paso 1: Convertir los 7.50 g de NH3 a moles (para poder usar la receta).
- Paso 2: Usar la receta (relación 1:2) para ver cuántos moles de N2 se necesitan.
- Paso 3: Convertir esos moles de N2 a gramos (que es lo que nos piden).
Solución
Ejemplo
El aluminio puro se prepara por la electrólisis del óxido de alumino de acuerdo con la siguiente ecuación:
- Balancee la ecuación
- ¿Qué masa en gramos de óxido de aluminio se requiere para preparar 27.0 g (1 mol) de aluminio?
Solución
La ecuación balanceada queda así:
La masa de óxido de alumino requerido es:
Ejemplo
El silicio que se utiliza en los dispositivos electrónicos se manufactura en un proceso representado por la siguiente reacción:
Una muestra de 225 g de tetracloruro de silicio, , reacciona con un exceso (más de lo necesario) de Mg. ¿Cuántos moles de silicio se producen?
Estrategia Socrática
Usemos nuestro mapa:
- Punto de Partida: 225 g de SiCl4.
- Destino: Moles de Si.
- El Puente: La receta dice 1 SiCl4 → 1 Si.
- La Pregunta Clave: No podemos cruzar el puente con gramos. ¿Qué debemos hacer primero? Exacto, convertir los 225 g de SiCl4 a moles. Una vez en moles, el cruce es directo porque la relación es 1 a 1.
Solución
Ejemplo
Cuando la , NH2)2CO, es activada por la enzima ureasa en la presencia de agua, se produce amoniaco más dióxido de carbono. La ureasa, el catalizador, se coloca en la parte superior de la flecha.
Si hay un exceso de agua (más de lo necesario para la reacción), ¿cuántos gramos de y amoníaco se producen con 0.83 moles de urea?
Estrategia Socrática
Este parece doble, pero es el mismo viaje dos veces:
- Punto de Partida: 0.83 moles de Urea. ¡Genial! Ya estamos en moles, así que ya estamos en la entrada del puente.
- Destino 1 (CO2): La receta dice 1 Urea → 1 CO2.
- Calcula los moles de CO2 (es 1 a 1, fácil).
- Convierte esos moles a gramos.
- Destino 2 (NH3): La receta dice 1 Urea → 2 NH3.
- Calcula los moles de NH3 (es el doble).
- Convierte esos moles a gramos.
Solución
La Llegada (Reflexión)
¡Felicidades! Has completado el viaje. Hoy no solo aprendiste a resolver problemas de química, aprendiste a usar una herramienta poderosa: la relación molar.
Recuerda siempre:
- Las ecuaciones son recetas.
- Los coeficientes son las proporciones de los ingredientes.
- Tu objetivo es siempre encontrar el puente (moles) para cruzar de lo que tienes a lo que quieres.
Ahora que tienes el mapa y sabes cómo usarlo, el mundo de la estequiometría es tuyo para explorar.
Ejercicios de Práctica
A continuación te presentamos una serie de ejercicios para que pongas a prueba lo aprendido. Resuélvelos en tu cuaderno y luego utiliza la Calculadora Estequiométrica que se encuentra al final para verificar si tus respuestas son correctas.
¡Comprueba tus resultados!
Utiliza la calculadora estequiométrica interactiva que aparece en el menú flotante del lado derecho para verificar tus resultados. Ingresa la ecuación química y los datos del problema para verificar tus cálculos.
Ejercicio 1: Combustión del Metano
El metano (CH4) es el componente principal del gas natural. Su combustión completa produce dióxido de carbono y agua:
Pregunta: ¿Cuántos gramos de agua (H2O) se producen al quemar completamente 16.0 g de metano (CH4)?
Mapa de Ruta:
- Inicio: 16.0 g de Metano (CH4)
- Destino: Gramos de Agua (H2O)
- Puente: 1 mol CH4 produce 2 moles H2O
Cálculos:
Ejercicio 2: Descomposición del Clorato de Potasio
El clorato de potasio es utilizado frecuentemente en laboratorios para producir pequeñas cantidades de oxígeno:
Pregunta: Si calentamos una muestra que contiene 2.5 moles de KClO3, ¿cuántos moles de oxígeno (O2) se producirán?
Mapa de Ruta:
- Inicio: 2.5 moles de KClO3 (¡Ya estamos en moles!)
- Destino: Moles de Oxígeno (O2)
- Puente: 2 mol KClO3 producen 3 moles O2
Cálculos:
Ejercicio 3: Producción de Herrumbre
El hierro expuesto al aire húmedo se oxida formando óxido de hierro (III), conocido comúnmente como herrumbre:
Pregunta: Calcula cuántos gramos de óxido de hierro (III) (Fe2O3) se formarán si reaccionan completamente 111.7 g de hierro (Fe).
Mapa de Ruta:
- Inicio: 111.7 g de Hierro (Fe)
- Destino: Gramos de Óxido (Fe2O3)
- Puente: 4 mol Fe producen 2 moles Fe2O3
Cálculos:
Ejercicio 4: Fotosíntesis
Las plantas convierten el dióxido de carbono en glucosa mediante la fotosíntesis:
Pregunta: ¿Cuántos gramos de glucosa (C6H12O6) puede producir una planta a partir de 88.0 g de dióxido de carbono (CO2) (asumiendo suficiente agua y luz)?
Mapa de Ruta:
- Inicio: 88.0 g de CO2
- Destino: Gramos de Glucosa (C6H12O6)
- Puente: 6 mol CO2 producen 1 mol Glucosa
Cálculos:
Ejercicio 5: Síntesis de Amoníaco (Proceso Haber)
El amoníaco es fundamental para la producción de fertilizantes:
Pregunta: ¿Cuántos gramos de amoníaco (NH3) se obtienen si reaccionan completamente 5.0 moles de nitrógeno (N2)?
Mapa de Ruta:
- Inicio: 5.0 moles de N2 (¡Ya estamos en moles!)
- Destino: Gramos de Amoníaco (NH3)
- Puente: 1 mol N2 produce 2 moles NH3
Cálculos:
Ejercicio 6: Electrólisis del Agua
El agua se puede descomponer en sus elementos mediante electricidad:
Pregunta: Si descomponemos 36.0 g de agua (H2O), ¿cuántos moles de hidrógeno gas (H2) se obtendrán?
Mapa de Ruta:
- Inicio: 36.0 g de Agua (H2O)
- Destino: Moles de Hidrógeno (H2)
- Puente: 2 mol H2O producen 2 moles H2 (1:1)
Cálculos:
Ejercicio 7: Combustión del Propano
El propano es un combustible común en estufas y parrillas:
Pregunta: ¿Cuántos moles de dióxido de carbono (CO2) se producen por la combustión de 10.0 moles de propano (C3H8)?
Mapa de Ruta:
- Inicio: 10.0 moles de Propano (C3H8)
- Destino: Moles de CO2
- Puente: 1 mol C3H8 produce 3 moles CO2
Cálculos:
Ejercicio 8: Formación de Sal de Mesa
El sodio reacciona vigorosamente con el cloro para formar cloruro de sodio:
Pregunta: ¿Qué masa en gramos de sal (NaCl) se formará si reaccionan 46.0 g de sodio (Na) con suficiente cloro?
Mapa de Ruta:
- Inicio: 46.0 g de Sodio (Na)
- Destino: Gramos de Sal (NaCl)
- Puente: 2 mol Na producen 2 moles NaCl (1:1)
Cálculos:
Ejercicio 9: Descomposición del Agua Oxigenada
El peróxido de hidrógeno se descompone en agua y oxígeno:
Pregunta: ¿Cuántos gramos de oxígeno (O2) se liberan a partir de la descomposición de 4.0 moles de H2O2?
Mapa de Ruta:
- Inicio: 4.0 moles de H2O2
- Destino: Gramos de Oxígeno (O2)
- Puente: 2 mol H2O2 producen 1 mol O2
Cálculos:
Ejercicio 10: Neutralización Ácido-Base
El ácido clorhídrico reacciona con el hidróxido de sodio para formar sal y agua:
Pregunta: Si tienes 73.0 g de ácido clorhídrico (HCl), ¿cuántos gramos de cloruro de sodio (NaCl) puedes producir?
Mapa de Ruta:
- Inicio: 73.0 g de HCl
- Destino: Gramos de Sal (NaCl)
- Puente: 1 mol HCl produce 1 mol NaCl
Cálculos:
Ejercicio 11: Combustión del Butano
El butano se utiliza en encendedores y estufas portátiles:
Pregunta: ¿Cuántos gramos de oxígeno (O2) se necesitan para reaccionar completamente con 50.0 g de butano (C4H10)?
Mapa de Ruta:
- Inicio: 50.0 g de Butano (C4H10)
- Destino: Gramos de Oxígeno (O2)
- Puente: 2 mol C4H10 requieren 13 moles O2
Cálculos:
Ejercicio 12: Descomposición Térmica de la Caliza
El carbonato de calcio se descompone en cal viva y dióxido de carbono:
Pregunta: Si deseas obtener 100.0 g de óxido de calcio (CaO), ¿cuántos gramos de carbonato de calcio (CaCO3) debes calentar?
Mapa de Ruta:
- Inicio: 100.0 g de CaO (Producto deseado)
- Destino: Gramos de CaCO3 (Reactivo necesario)
- Puente: 1 mol CaO proviene de 1 mol CaCO3
Cálculos:
Ejercicio 13: Síntesis de Agua
El hidrógeno y el oxígeno reaccionan violentamente para formar agua:
Pregunta: ¿Cuántos moles de hidrógeno (H2) se necesitan para reaccionar completamente con 3.0 moles de oxígeno (O2)?
Mapa de Ruta:
- Inicio: 3.0 moles de Oxígeno (O2)
- Destino: Moles de Hidrógeno (H2)
- Puente: 1 mol O2 reacciona con 2 moles H2
Cálculos:
Ejercicio 14: Reacción de Aluminio y Cloro
El aluminio reacciona con cloro gas para formar cloruro de aluminio:
Pregunta: Para producir 200.0 g de cloruro de aluminio (AlCl3), ¿cuántos gramos de cloro gas (Cl2) son necesarios?
Mapa de Ruta:
- Inicio: 200.0 g de AlCl3
- Destino: Gramos de Cloro (Cl2)
- Puente: 2 mol AlCl3 requieren 3 moles Cl2
Cálculos:
- Moles de AlCl3 = 200.0 g / 133.341 g/mol ≈ 1.4999 mol
- Usando el puente (2:3): Moles Cl2 = 1.4999 mol × (3/2) = 2.2499 mol
- Gramos Cl2 = 2.2499 mol × 70.906 g/mol ≈ 159.529 g
Ejercicio 15: Combustión del Octano (Gasolina)
El octano es un componente clave de la gasolina:
Pregunta: Si en una reacción se producen 500.0 g de dióxido de carbono (CO2), ¿cuántos gramos de agua (H2O) se formaron simultáneamente?
Mapa de Ruta:
- Inicio: 500.0 g de CO2
- Destino: Gramos de Agua (H2O)
- Puente: 16 mol CO2 se producen junto con 18 moles H2O
Cálculos:
Ejercicio 16: Neutralización Sulfúrico-Sosa
El ácido sulfúrico reacciona con el hidróxido de sodio:
Pregunta: ¿Cuántos gramos de hidróxido de sodio (NaOH) se necesitan para neutralizar completamente 49.0 g de ácido sulfúrico (H2SO4)?
Mapa de Ruta:
- Inicio: 49.0 g de H2SO4
- Destino: Gramos de NaOH
- Puente: 1 mol H2SO4 neutraliza 2 moles NaOH
Cálculos:
Ejercicio 17: Descomposición del Amoníaco
El amoníaco puede descomponerse en sus elementos a altas temperaturas:
Pregunta: Si se producen 4.0 moles de nitrógeno (N2), ¿cuántos moles de hidrógeno (H2) se producen al mismo tiempo?
Mapa de Ruta:
- Inicio: 4.0 moles de Nitrógeno (N2)
- Destino: Moles de Hidrógeno (H2)
- Puente: 1 mol N2 se produce junto con 3 moles H2
Cálculos:
Ejercicio 18: Respiración Celular
La glucosa reacciona con oxígeno para liberar energía:
Pregunta: ¿Cuántos gramos de oxígeno (O2) se requieren para reaccionar con 90.0 g de glucosa (C6H12O6)?
Mapa de Ruta:
- Inicio: 90.0 g de Glucosa
- Destino: Gramos de Oxígeno (O2)
- Puente: 1 mol Glucosa reacciona con 6 moles O2
Cálculos:
Ejercicio 19: Reacción Zinc-Ácido
El zinc reacciona con ácido clorhídrico liberando hidrógeno:
Pregunta: Si deseas producir 0.5 moles de hidrógeno gas (H2), ¿cuántos gramos de zinc (Zn) necesitas?
Mapa de Ruta:
- Inicio: 0.5 moles de Hidrógeno (H2)
- Destino: Gramos de Zinc (Zn)
- Puente: 1 mol H2 proviene de 1 mol Zn
Cálculos:
Ejercicio 20: Reacción Termita
El aluminio reacciona con óxido de hierro (III) generando gran cantidad de calor:
Pregunta: Si la reacción produce 100.0 g de hierro fundido (Fe), ¿cuántos gramos de óxido de aluminio (Al2O3) se formaron?
Mapa de Ruta:
- Inicio: 100.0 g de Hierro (Fe)
- Destino: Gramos de Óxido de Aluminio (Al2O3)
- Puente: 2 mol Fe se producen junto con 1 mol Al2O3
Cálculos: