Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
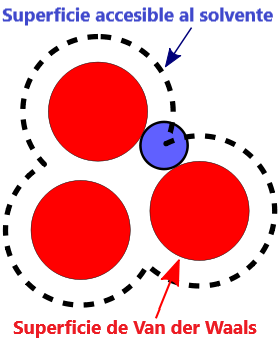
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Estequiometría
Video con Descarga Progresiva Optimizada
Guía de Estudio: Reactivo Limitante
Reactivo Limitante: El Cuello de Botella
Analogía: La Fábrica de Automóviles
Imagina que eres el gerente de una fábrica de automóviles. Tu línea de ensamblaje tiene una "receta" muy estricta:
Un día, revisas tu inventario y encuentras que tienes:
- 5 Carrocerías
- 16 Llantas
La Pregunta del Millón: ¿Cuántos automóviles completos puedes fabricar?
Hagamos las cuentas:
- Con 5 carrocerías, podrías hacer 5 autos (si tuvieras suficientes llantas).
- Con 16 llantas, solo puedes hacer 4 autos (porque 16 ÷ 4 = 4).
El Resultado: Solo puedes fabricar 4 autos. En ese momento, se te acaban las llantas. Aunque te sobre una carrocería, no puedes vender un coche sin ruedas.
En este caso, las Llantas son tu Reactivo Limitante: ellas deciden cuándo se detiene la producción.
¿Por qué me debería importar esto?
Quizás pienses: "Bueno, yo no fabrico coches". Pero, ¿qué tal si fabricaras medicinas que salvan vidas?
Imagina la síntesis de un nuevo fármaco contra el cáncer. Uno de los ingredientes clave cuesta miles de dólares por gramo, mientras que el otro es muy barato (como agua o sales comunes).
Como químico responsable, tu misión es asegurar que ni una sola molécula del ingrediente caro se desperdicie. ¿Cómo lo logras? Usas un exceso del ingrediente barato. De esta forma, garantizas que el ingrediente costoso sea el Reactivo Limitante y se consuma en su totalidad para formar el medicamento. ¡Así es como la estequiometría ahorra millones y hace los tratamientos más accesibles!

Escuchar Podcast
Haz clic en el botón para cargar y reproducir el audio.
Investigación Química: El Caso del Carbono
Ahora, apliquemos nuestra lógica de detectives a una reacción real. Supongamos que mezclamos:
- 12 g de Carbono (C)
- 64 g de Oxígeno (O2)
La reacción es:
Paso 1: No te dejes engañar por las apariencias
A simple vista, 64 g de oxígeno parece mucho más que 12 g de carbono. Podrías pensar: "Seguro el carbono se acaba primero porque hay menos". ¡Alto ahí!
Las reacciones químicas no "ven" el peso en gramos; ellas "cuentan" partículas (moles). Para comparar justamente, debemos traducir todo al idioma de la química: Moles.
Traducción a Moles:
- Carbono: 12 g ÷ 12.01 g/mol ≈ 1 mol de C
- Oxígeno: 64 g ÷ 32.00 g/mol = 2 moles de O2
Paso 2: Interroga a la Receta
La ecuación química (C + O2 → CO2) es nuestra receta. Nos dice que la proporción es 1:1.
"Por cada 1 mol de Carbono, necesito exactamente 1 mol de Oxígeno".
Paso 3: El Veredicto
Comparemos lo que tenemos con lo que necesitamos:
- Tienes 1 mol de C. Según la receta, necesitas 1 mol de O2 para reaccionar con él.
- ¡Pero tienes 2 moles de O2!
Conclusión: Tienes oxígeno de sobra (te sobra 1 mol). Por lo tanto, el Carbono es el que se acabará primero. El Carbono es nuestro Reactivo Limitante.
Resultado
El Carbono limita la reacción. Él determina cuánto CO2 se producirá (en este caso, 1 mol de CO2, que son 44 g).
¿Y qué pasa con lo que sobra? (El Exceso)
En nuestro ejemplo, sobraron 32 g de oxígeno (1 mol). ¿Desaparecen? No. Quedan mezclados en el tanque junto con el producto (CO2).
El reto de la pureza: En la industria, ese "sobrante" no es inofensivo. Ahora tienes una mezcla de CO2 y O2. Si quieres vender CO2 puro, tendrás que gastar dinero y energía en separarlos. Por eso, los ingenieros químicos deben calcular con precisión: a veces conviene tener exceso para asegurar una reacción completa, pero siempre hay un costo asociado a limpiar el desorden después.
Práctica Guiada: Dominando el Reactivo Limitante
A continuación, resolveremos 3 ejemplos clave usando nuestra estrategia de detectives. ¡Intenta anticipar la respuesta antes de leer la solución!
Ejemplo 1: El Asado del Domingo (Moles)
Imagina que estás quemando gas propano (C3H8) en tu parrilla. La reacción es:
Si tienes 2 moles de Propano y 7 moles de Oxígeno, ¿cuál se acabará primero?
Estrategia Socrática
- Interroga a la Receta: La ecuación dice: "Por cada 1 mol de Propano, NECESITO 5 moles de Oxígeno".
- Calcula lo necesario: Si tienes 2 moles de Propano, ¿cuánto Oxígeno necesitas? (2 × 5 = 10 moles).
- Compara con la realidad: Necesitas 10 moles de Oxígeno, pero solo tienes 7.
- Veredicto: ¡No tienes suficiente Oxígeno! Se acabará antes de que puedas quemar todo el propano.
Solución
El Oxígeno (O2) es el Reactivo Limitante.
Ejemplo 2: Síntesis de Amoníaco (Gramos)
Hacemos reaccionar 50.0 g de Nitrógeno (N2) con 10.0 g de Hidrógeno (H2) para producir amoníaco:
¿Cuál es el reactivo limitante y cuántos gramos de NH3 se producen?
Estrategia Socrática
- Paso 1: Traducción (Gramos a Moles). Usamos masas atómicas precisas (N=14.007,
H=1.008).
- Moles N2 = 50.0 g / 28.014 g/mol = 1.785 mol
- Moles H2 = 10.0 g / 2.016 g/mol = 4.960 mol
- Paso 2: La Prueba del "Si... entonces".
- Si uso todo el N2 (1.785 mol): Necesito 3 veces más H2 (1.785 × 3 = 5.355 mol).
- ¿Tengo 5.355 mol de H2? No, solo tengo 4.960 mol.
- Veredicto: Me falta Hidrógeno. El H2 es el limitante.
Solución (Cálculo del Producto)
Usamos el limitante (H2) para calcular el producto:
Ejemplo 3: El Sobrante (Exceso)
En la reacción anterior, determinamos que el N2 estaba en exceso. ¿Cuánto N2 sobró sin reaccionar?
Estrategia Socrática
- Lógica: Sobrante = (Lo que tenía al inicio) - (Lo que se consumió).
- ¿Cuánto tenía? 50.0 g de N2 (1.785 mol).
- ¿Cuánto se consumió? El reactivo limitante (H2) determina cuánto
N2 se gasta.
- La receta dice: 3 moles H2 consumen 1 mol N2.
- Teníamos 4.960 mol H2 (el limitante).
- N2 consumido = 4.960 mol H2 × (1 mol N2 / 3 mol H2) = 1.653 mol N2.
- Traducción a gramos: 1.653 mol N2 × 28.014 g/mol = 46.31 g N2 consumidos.
Solución
Laboratorio Virtual: Reactivo Limitante
Instrucciones de Práctica
Para un mejor aprendizaje, te recomendamos sacar tu cuaderno 📓 y tratar de resolver los ejercicios en papel antes de ver la solución.
Si te atascas, haz clic en "Ver Respuesta" para revisar el procedimiento. Además, ¡tienes la Calculadora Pro en el menú flotante de la derecha para verificar tus cálculos!
Ejercicio 4: Aluminio y Cloro (Gramos)
Se mezclan 27.0 g de Al (1 mol) con 71.0 g de Cl2 (1 mol). ¿Cuál es el limitante?
Paso 1 (Moles): Tenemos 1 mol de Al y 1 mol de Cl2.
Paso 2 (Receta): La ecuación pide 2 Al por cada 3 Cl2 (o sea, necesitas más Cl2 que Al).
Análisis: Si tienes cantidades iguales (1 y 1), se acabará primero el que se necesita en mayor cantidad.
Veredicto: El Cloro (Cl2) es el reactivo limitante.
Ejercicio 5: Combustión de Metano (Producto)
Si reaccionan 1 mol de CH4 con 1 mol de O2, ¿cuántos moles de CO2 se producen?
Identificar Limitante:
- Para 1 mol de CH4 necesitas 2 moles de O2.
- Solo tienes 1 mol de O2. ¡Te falta aire!
- Limitante: Oxígeno (O2).
Cálculo: Usamos el limitante (1 mol O2). La relación O2:CO2 es 2:1.
1 mol O2 × (1 mol CO2 / 2 mol O2) = 0.5 mol CO2.
Ejercicio 6: Óxido de Magnesio (Gramos)
Reaccionan 10.0 g de Mg con 10.0 g de O2. ¿Cuál es el limitante?
Paso 1 (Moles):
- Mg: 10.0 g / 24.305 g/mol = 0.411 mol
- O2: 10.0 g / 31.998 g/mol = 0.313 mol
Paso 2 (Prueba): La receta es 2:1. Necesitas el doble de Mg que de O2.
- Para 0.313 mol de O2 necesitas: 0.313 × 2 = 0.626 mol de Mg.
- ¿Tienes 0.626 mol de Mg? No, solo tienes 0.411.
Veredicto: El Magnesio (Mg) es el reactivo limitante.
Ejercicio 7: Sal de Mesa (Exceso)
Si tienes 4 moles de Na y 1 mol de Cl2, ¿cuánto Na sobra?
Análisis:
- Limitante: Cl2 (1 mol necesita solo 2 moles de Na).
- Consumo: 1 mol Cl2 consume 2 moles Na.
- Sobrante: Tenías 4 moles Na - 2 moles consumidos = 2 moles Na sobran.
Ejercicio 8: Ácido Sulfúrico
Si tienes cantidades infinitas de agua y oxígeno, pero solo 5 moles de SO2, ¿quién limita la reacción?
Lógica: El reactivo limitante es el que se acaba primero. Si tienes "infinito" de los otros, el único que puede acabarse es el SO2.
Veredicto: El Dióxido de Azufre (SO2) es el limitante.
Ejercicio 9: Nitrato de Plata
Mezclas soluciones con 0.5 moles de AgNO3 y 0.8 moles de NaCl. ¿Cuánto AgCl (precipitado) obtienes?
Identificar Limitante: La relación es 1:1.
- Tienes menos AgNO3 (0.5) que NaCl (0.8).
- Limitante: AgNO3.
Cálculo: 1 mol AgNO3 produce 1 mol AgCl.
0.5 mol AgNO3 → 0.5 mol AgCl.
Ejercicio 10: Acetileno (Soldadura)
Si reaccionan 1 mol de Carburo de Calcio (CaC2) con 1 mol de Agua, ¿cuánto acetileno (C2H2) se produce?
Identificar Limitante:
- Receta: 1 CaC2 necesita 2 H2O.
- Tienes 1 de cada uno. Te falta agua (necesitarías 2).
- Limitante: Agua (H2O).
Cálculo: Usamos el agua.
1 mol H2O × (1 mol C2H2 / 2 mol H2O) = 0.5 mol C2H2.
Ejercicio 11: Termita (Hierro Fundido)
Reaccionan 1 mol de Óxido Férrico con 1 mol de Aluminio. ¿Cuál es el limitante?
Análisis:
- Receta: 1 Fe2O3 necesita 2 Al.
- Tienes 1 Fe2O3, así que necesitarías 2 Al.
- Solo tienes 1 Al. ¡Te falta Aluminio!
Veredicto: El Aluminio (Al) es el reactivo limitante.
Ejercicio 12: Fotosíntesis (Limitante CO2)
Si una planta tiene 12 moles de H2O pero solo 3 moles de CO2, ¿cuánta glucosa puede producir?
Identificar Limitante:
- La proporción es 6:6 (o sea 1:1). Deberías tener cantidades iguales.
- Tienes mucho menos CO2 (3 moles) que H2O (12 moles).
- Limitante: CO2.
Cálculo:
3 mol CO2 × (1 mol Glucosa / 6 mol CO2) = 0.5 mol Glucosa.
Ejercicio 13: Neutralización (Gramos)
36.5 g de HCl (1 mol) reaccionan con 20.0 g de NaOH (0.5 mol). ¿Cuánto NaCl se forma?
Identificar Limitante:
- Moles HCl: 1.0 mol.
- Moles NaOH: 0.5 mol.
- Relación 1:1. El NaOH es el menor (0.5), así que es el limitante.
Cálculo:
0.5 mol NaOH → 0.5 mol NaCl.
Masa NaCl = 0.5 mol × 58.44 g/mol = 29.22 g NaCl.
Ejercicio 14: Urea (Industrial)
Si alimentas al reactor con 50 moles de NH3 y 50 moles de CO2, ¿cuál reactivo sobra?
Análisis:
- Receta: Necesitas el doble de NH3 que de CO2.
- Si usas los 50 moles de CO2, necesitarías 100 moles de NH3.
- ¡No tienes suficiente NH3! (Solo tienes 50).
Veredicto: El NH3 es el limitante. Por lo tanto, el CO2 es el que sobra.
Ejercicio 15: El Cohete (Hidracina)
Si cargas el tanque con 100 kg de Hidracina (N2H4) y 100 kg de Oxígeno, ¿se consumirán ambos por completo?
Paso 1 (Moles):
- N2H4 (32.046 g/mol): 100,000 / 32.046 = 3,120.5 mol.
- O2 (31.998 g/mol): 100,000 / 31.998 = 3,125.2 mol.
Paso 2 (Receta): La relación es 1:1.
Veredicto: Aunque parezcan iguales, tienes menos moles de Hidracina (3120 vs 3125). Por lo tanto, la Hidracina (N2H4) se consume primero y es el limitante.
Rendimiento Porcentual: Expectativa vs. Realidad
Hasta ahora, nuestros cálculos han asumido un mundo perfecto donde cada átomo reacciona exactamente como debe. Esto se llama Rendimiento Teórico (lo que dice la calculadora).
Sin embargo, en el laboratorio real, "cosas pasan": derrames, reacciones incompletas o reacciones secundarias no deseadas. La cantidad de producto que realmente pesas en la balanza se llama Rendimiento Real.
La Fórmula de la Eficiencia:
Ejemplo 1: La Analogía de las Galletas
Imagina que sigues una receta que promete producir 20 galletas (Rendimiento Teórico).
Sin embargo, durante el proceso:
- Te comiste un poco de masa cruda.
- Dos galletas se quemaron en el horno.
- Una se cayó al suelo.
Al final, pones en el plato solo 17 galletas (Rendimiento Real).
Tu eficiencia fue:
Ejemplo 2: Reacción Química (Síntesis de Aspirina)
Un estudiante realiza una reacción para producir aspirina. Según sus cálculos estequiométricos (usando el reactivo limitante), debería haber obtenido 50.0 gramos de aspirina.
Al finalizar el experimento, pesa su producto seco y obtiene 45.0 gramos.
Cálculo del Rendimiento:
- Teórico (Calculadora): 50.0 g
- Real (Balanza): 45.0 g
¡Un 90% es una calificación de 'A' en química!