Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
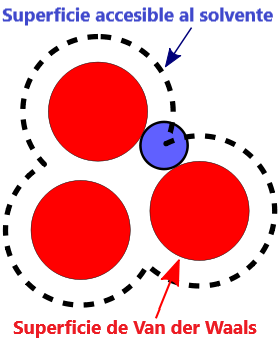
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Portada

Escuchar Podcast
Haz clic en el botón para cargar y reproducir el audio.
¿La Receta de la Química?
Imagina que quieres hornear un pastel. No basta con saber que necesitas harina, huevos y azúcar; es crucial saber cuánto de cada ingrediente. Si pones demasiada harina, el pastel será duro; si pones demasiados huevos, no cuajará bien.
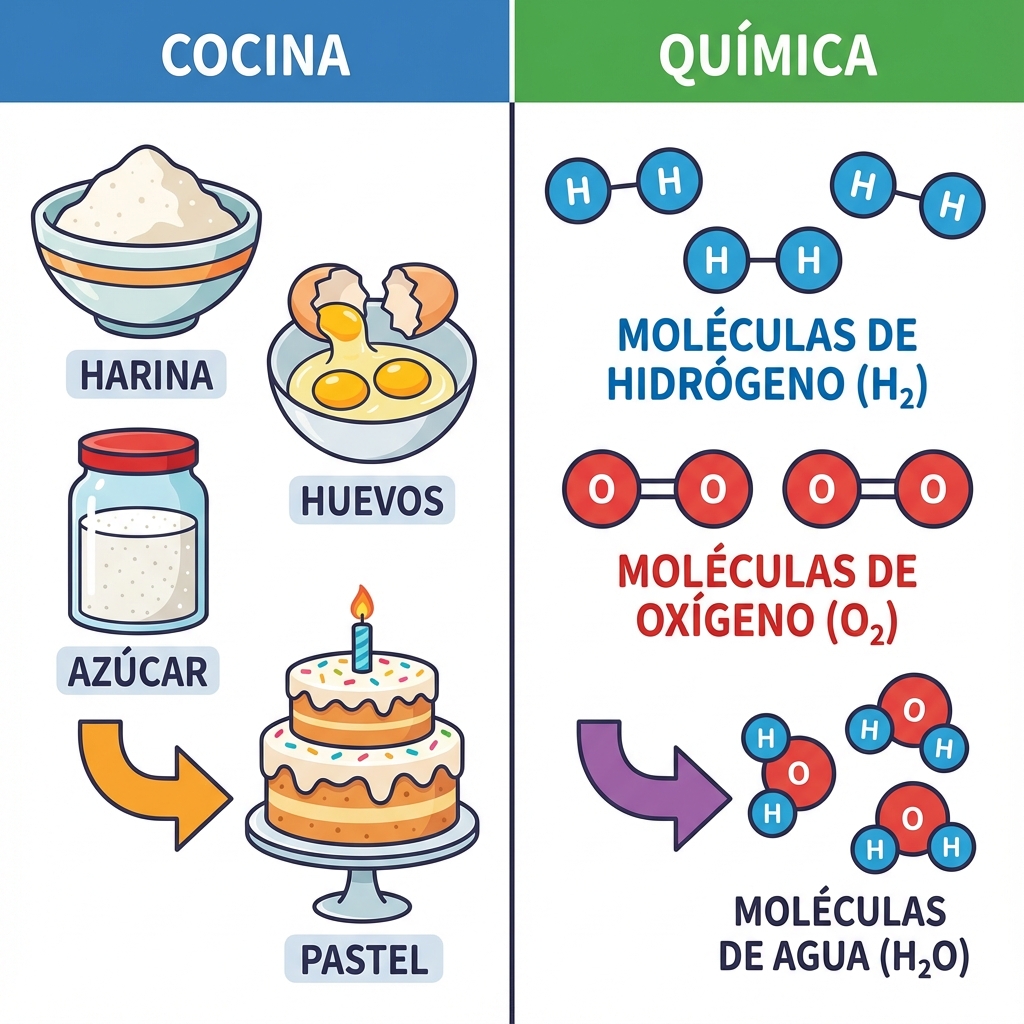
En la química sucede exactamente lo mismo. No es suficiente saber que el Hidrógeno reacciona con el Oxígeno para formar agua. Necesitamos saber la proporción exacta: 2 átomos de Hidrógeno por cada 1 de Oxígeno. Esa "receta perfecta", esa matemática de las reacciones, es lo que llamamos Estequiometría.
Es la herramienta que nos permite pasar de la teoría a la práctica, garantizando seguridad, eficiencia y éxito en todo, desde la fabricación de medicamentos hasta el lanzamiento de cohetes.
Introducción Formal
La estequiometría es mucho más que simples cálculos; es la contabilidad de la química. Se define como el estudio de las relaciones cuantitativas (de masa, moles, volumen, etc.) entre los reactivos y productos en una reacción química. Estas relaciones se basan en leyes fundamentales, principalmente la Ley de Conservación de la Masa de Lavoisier, que nos dice que la materia no se crea ni se destruye, solo se transforma.
Gracias a la estequiometría, los químicos pueden:
- Predecir cuánto producto se obtendrá de una reacción.
- Calcular cuánto reactivo se necesita para producir una cantidad deseada.
- Determinar la pureza de una muestra o la fórmula de un compuesto desconocido.
Enfoques para los Cálculos Químicos:
Generalmente, enfrentamos dos métodos al resolver problemas:
- Uso de Fórmulas Algebraicas: Implica insertar valores en una ecuación memorizada (como n = m MM ) para despejar una incógnita.
- Análisis Dimensional (Conversión de Unidades): Este es el corazón de la estequiometría. En lugar de memorizar fórmulas específicas para cada caso, utilizamos las unidades como guía. Multiplicamos la cantidad conocida por una serie de factores de conversión (fracciones que equivalen a 1) para "cancelar" las unidades que no queremos y llegar a las que necesitamos.
En este curso, nos centraremos en el Análisis Dimensional. Este método es sumamente poderoso porque minimiza la memorización y fomenta el razonamiento lógico: si las unidades se cancelan correctamente y queda la unidad deseada, es muy probable que el planteamiento del problema sea correcto.
Unidad Fórmula
La Unidad Fórmula es la unidad más pequeña y representativa de una sustancia que conserva su composición química exacta. Es la "receta mínima" de esa sustancia.
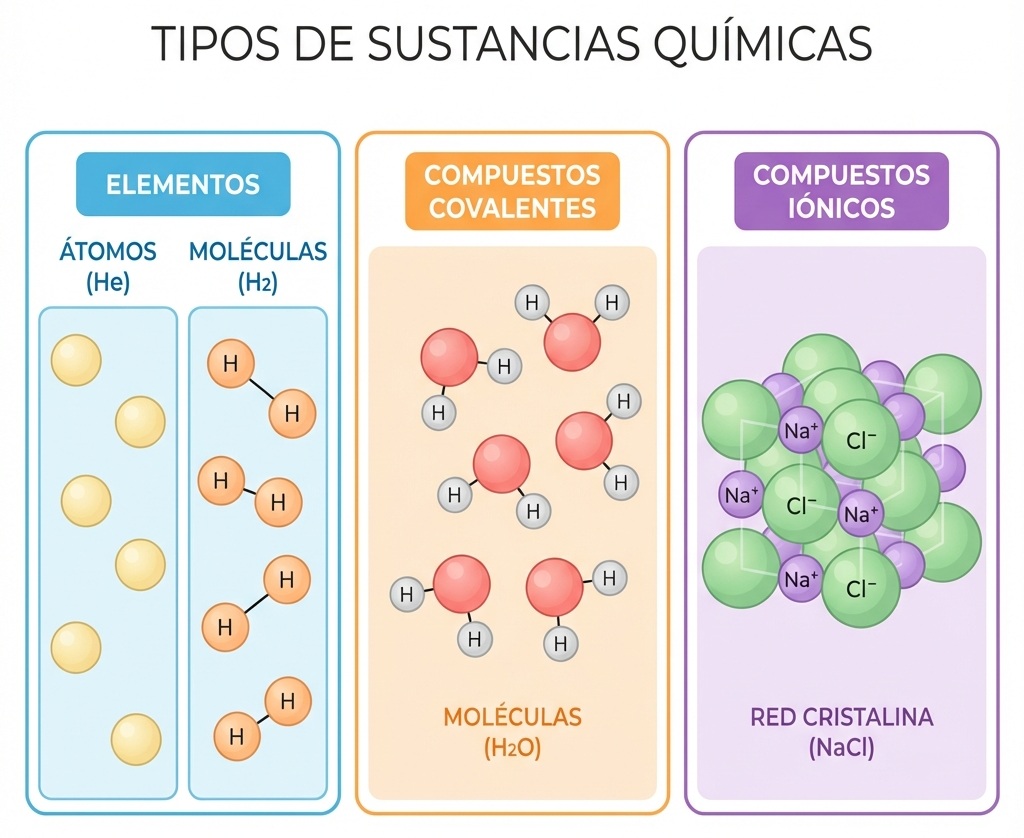
Dependiendo del tipo de sustancia, esta unidad puede tomar diferentes formas:
- Para Elementos: Puede ser un átomo individual (como el Helio, He) o una molécula diatómica (como el Hidrógeno, H2).
- Para Compuestos Covalentes (Moleculares): La unidad fórmula es la molécula misma. Por ejemplo, en el agua (H2O), la unidad es una molécula discreta formada por 2 H y 1 O.
- Para Compuestos Iónicos: Aquí no existen moléculas aisladas, sino redes cristalinas gigantes. En este caso, la unidad fórmula representa la proporción más simple de iones. Por ejemplo, en el cloruro de sodio (NaCl), no hay una "molécula de NaCl", sino una relación 1:1 entre iones sodio (Na+) e iones cloruro (Cl-).
En resumen, la fórmula química nos dice exactamente qué y cuánto hay en esa unidad fundamental.
Peso Molecular (Masa Molar)
El Peso Molecular (o más correctamente, Masa Molar para compuestos) es la suma de las masas atómicas de todos los átomos que componen una molécula. Se expresa en unidades de masa atómica (uma) o en gramos por mol (g/mol).
Para calcularlo, simplemente seguimos la "receta" de la fórmula química:
Ejemplo 1: El Agua (H2O)
La fórmula nos dice que tenemos 2 átomos de Hidrógeno y 1 de Oxígeno.
- H: 2 átomos × 1.008 g/mol = 2.016 g/mol
- O: 1 átomo × 15.999 g/mol = 15.999 g/mol
Peso Molecular Total = 18.015 g/mol
Ejemplo 2: Hidróxido de Calcio (Ca(OH)2)
El paréntesis indica que todo lo que está dentro se multiplica por el subíndice (2).
- Ca: 1 átomo × 40.08 g/mol = 40.08 g/mol
- O: 2 átomos × 16.00 g/mol = 32.00 g/mol
- H: 2 átomos × 1.008 g/mol = 2.016 g/mol
Peso Molecular Total = 74.096 g/mol
Composición Porcentual
A menudo necesitamos saber qué porcentaje de la masa total de un compuesto corresponde a un elemento específico. Esto es la composición porcentual.
Fórmula:
Ejemplo: ¿Cuánto Hidrógeno hay en el Agua?
Usando los datos del Ejemplo 1 (H2O):
- Masa del Hidrógeno (total): 2.016 g/mol
- Masa Total del Agua: 18.015 g/mol
Cálculo:
% H = 2.016 g/mol 18.015 g/mol × 100 = 11.19%
Esto significa que, por peso, el agua es un 11.19% Hidrógeno y un 88.81% Oxígeno, ¡aunque tenga el doble de átomos de Hidrógeno!
Ejemplo 2: ¿Cuánto Oxígeno hay en el Hidróxido de Calcio?
Usando los datos del Ejemplo 2 (Ca(OH)2):
- Masa del Oxígeno (total): 32.00 g/mol
- Masa Total del Ca(OH)2: 74.096 g/mol
Cálculo:
% O = 32.00 g/mol 74.096 g/mol × 100 = 43.19%
Así determinamos que el Hidróxido de Calcio contiene un 43.19% de Oxígeno por masa.
Ejercicios de Práctica
Antes de utilizar la calculadora, se sugiere determinar la composición porcentual de los siguientes compuestos en el cuaderno:
- Cloruro de Sodio (NaCl): Calcular el % de Na y % de Cl.
- Ácido Sulfúrico (H2SO4): Calcular el % de H, % de S y % de O.
- Glucosa (C6H12O6): Calcular el % de C, % de H y % de O.
Una vez obtenidos los resultados, se pueden verificar introduciéndolos en la calculadora mostrada abajo.
Calculadora de Composición Porcentual
Se puede introducir cualquier fórmula química para ver su desglose completo (Ej: H2SO4, C6H12O6, Ca(OH)2).
El Doble Filo de la Estequiometría: Nitroglicerina
La estequiometría no es solo números en una pizarra; es la diferencia entre una explosión devastadora y un medicamento que salva vidas. Un ejemplo fascinante de esto es la Nitroglicerina.
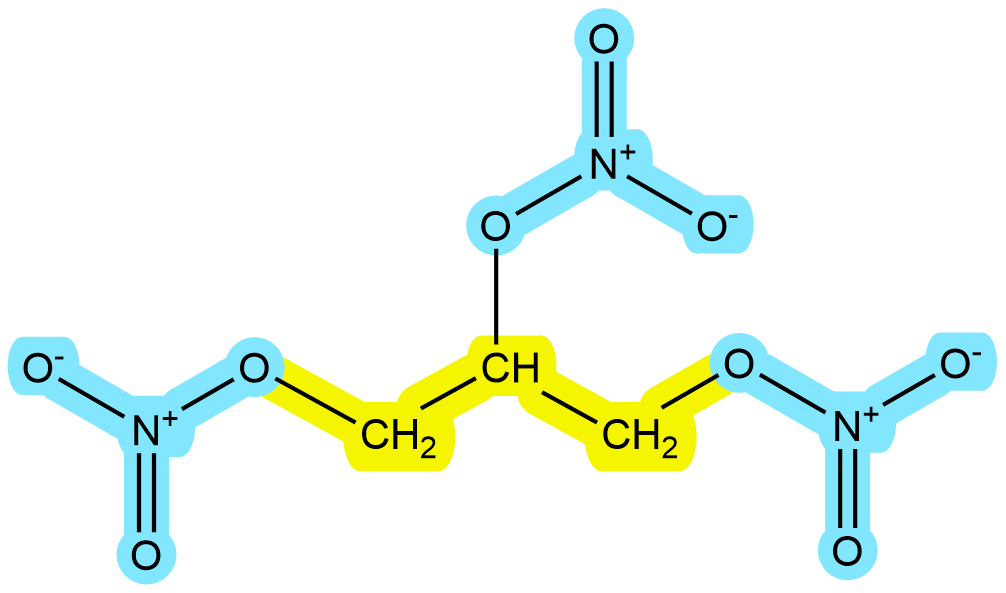
Esta molécula, famosa por ser el ingrediente activo de la dinamita inventada por Alfred Nobel, tiene una doble vida. Por un lado, es un explosivo extremadamente inestable y poderoso. Por otro lado, es un medicamento esencial utilizado para tratar la angina de pecho y los ataques cardíacos. ¿Cómo puede la misma sustancia tener efectos tan diferentes? La respuesta está en la química y en la dosis precisa (estequiometría).

El Lado Explosivo:
Cuando la nitroglicerina explota, se descompone violentamente liberando una enorme cantidad
de
gases calientes en una fracción de segundo. La ecuación química de su descomposición muestra
el inmenso cambio de volumen:
Observe la estequiometría: 4 moles de líquido producen 29 moles de gas. Esta expansión masiva y repentina es lo que crea la onda expansiva de la explosión.
El Lado Médico:
En medicina, la nitroglicerina se usa en cantidades minúsculas y controladas. En el cuerpo,
no
explota. En cambio, enzimas específicas la descomponen para liberar Óxido Nítrico
(NO).
El NO es una molécula señalizadora que le dice a los músculos lisos de los vasos sanguíneos
que se relajen. Esto dilata las arterias (vasodilatación), permitiendo que fluya más sangre
al
corazón y aliviando el dolor de pecho.
Aquí es donde la estequiometría es vital: una tableta típica contiene solo 0.3 a 0.6 miligramos de nitroglicerina. Los químicos farmacéuticos deben calcular y medir estas cantidades con extrema precisión. Una dosis demasiado baja no tendría efecto; una dosis masiva sería tóxica y peligrosa. Gracias a la estequiometría, podemos domar una molécula explosiva y convertirla en una herramienta para salvar corazones.
La Química en el Cuerpo:
La conversión de nitroglicerina a óxido nítrico es un proceso complejo catalizado por la
enzima mitocondrial ALDH2. Podemos representar la estequiometría simplificada de esta
bioactivación en dos pasos:
Estructura 3D de la Enzima ALDH2 (PDB: 1O02)
Interactúa con la molécula: Clic izquierdo para rotar, rueda del mouse para zoom.
1. Desnitración (Bioactivación): La nitroglicerina (GTN) reacciona con grupos tiol (RSH) en la enzima para producir 1,2-gliceril dinitrato (1,2-GDN) y nitrito:
2. Reducción a Óxido Nítrico: El nitrito resultante se reduce a óxido nítrico (NO), la molécula activa:
¿Toxicidad: La Molécula o el Producto?
Es importante aclarar que la toxicidad de una sobredosis de nitroglicerina se debe principalmente al Óxido Nítrico (NO) formado y no a la molécula de nitroglicerina en sí misma.
- Nitroglicerina como vehículo: Por sí sola, la molécula actúa como un "profármaco" o vehículo de entrega.
- El NO como agente activo: El cuerpo convierte la nitroglicerina en NO. En dosis masivas, el exceso de NO provoca una vasodilatación extrema e incontrolable (hipotensión severa) y puede oxidar la hemoglobina a metahemoglobina, impidiendo el transporte de oxígeno.
La nitroglicerina es la "bala", pero el NO es el "impacto". La estequiometría de la reacción en el cuerpo es lo que determina si el resultado es terapéutico o tóxico.
Cálculo de Producción de NO (Método del Factor Unitario)
A continuación, calcularemos la cantidad teórica de Óxido Nítrico (NO) que se libera en el cuerpo a partir de una dosis terapéutica común de nitroglicerina (0.3 mg a 0.6 mg), asumiendo la bioactivación descrita anteriormente (relación 1:1).
Datos necesarios:
- Masa Molar Nitroglicerina (C3H5N3O9): 227.1 g/mol
- Masa Molar Óxido Nítrico (NO): 30.01 g/mol
- Relación Molar: 1 mol Nitroglicerina produce 1 mol NO
1. Para la dosis mínima (0.3 mg de Nitroglicerina):
Estos cálculos demuestran cómo una cantidad extremadamente pequeña de principio activo (menos de una décima de miligramo de NO) es suficiente para generar un efecto biológico potente, resaltando la importancia de la precisión estequiométrica en farmacología.
Desafío: ¿Médico o Experto en Demoliciones?
Demuestra que dominas la estequiometría de la nitroglicerina.
1. ¿Qué enzima es clave para convertir la nitroglicerina en medicina?
Otra aplicación de la estequiometría en las ciencias médicas
La estequiometría es una rama de la química que se centra en la medición y el cálculo de las relaciones cuantitativas entre los reactantes y productos en una reacción química. En este caso clínico, exploraremos cómo la estequiometría puede utilizarse para ayudar en el tratamiento de un paciente.
El paciente en cuestión es un hombre de 50 años que acudió al hospital con síntomas de intoxicación por plomo. El plomo es un metal tóxico que puede causar daños en el sistema nervioso central, renal y hematopoyético. El paciente había estado trabajando en un taller de pintura y había estado expuesto a altos niveles de plomo durante un período prolongado.
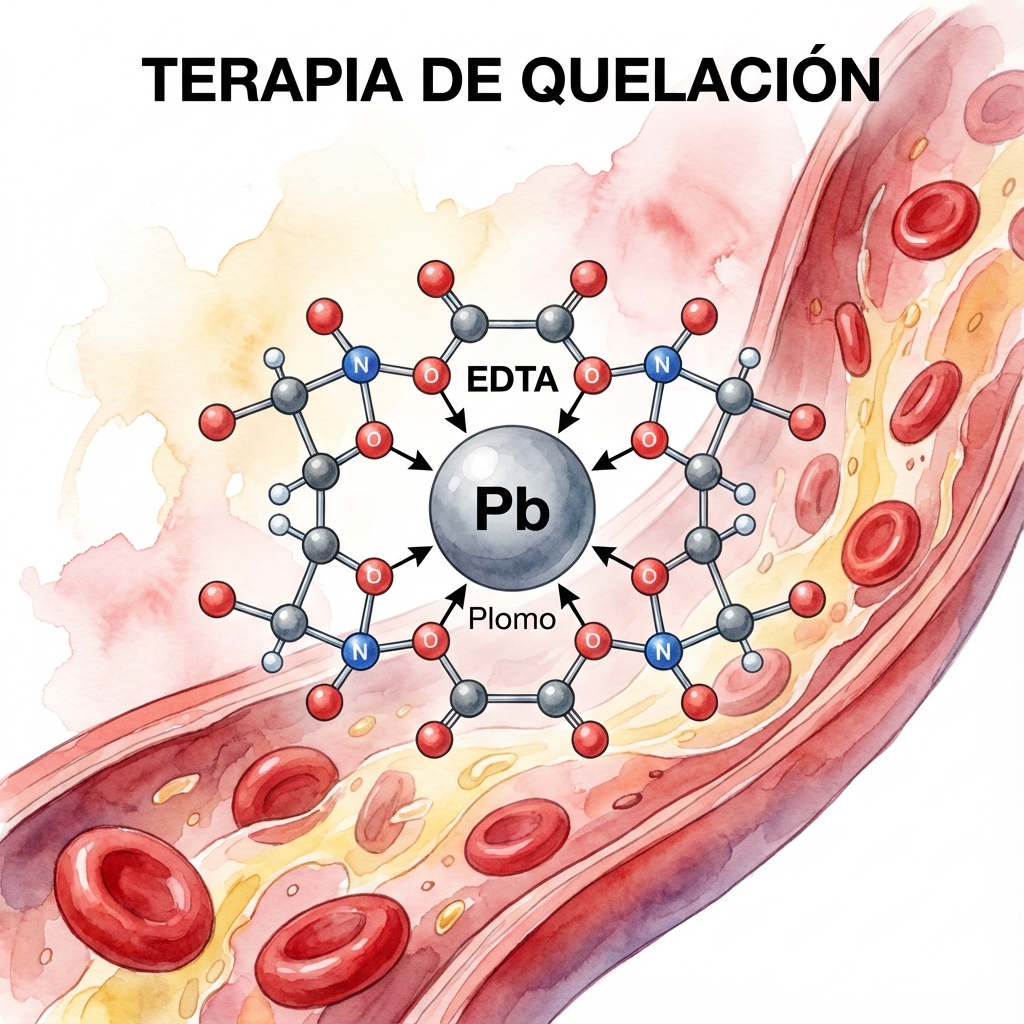
Ilustración de la molécula de EDTA formando un complejo estable con un ion de Plomo (Pb), permitiendo su eliminación.
Después de una evaluación inicial, se determinó que el paciente tenía una concentración de plomo en sangre de 60 microgramos por decilitro (µg/dL). La concentración normal de plomo en sangre en adultos es inferior a 5 µg/dL. Los médicos decidieron tratar al paciente con quelantes de plomo para ayudar a eliminar el exceso de plomo de su cuerpo.
El quelante de plomo utilizado en este caso fue el ácido etilendiaminotetraacético (EDTA). Este compuesto se une al plomo en la sangre y forma un complejo que se elimina a través de la orina. La dosis de EDTA se calculó utilizando la estequiometría para asegurarse de que se administrara suficiente quelante para eliminar todo el exceso de plomo en el cuerpo del paciente.
La estequiometría se basa en la ley de conservación de la masa, que establece que en una reacción química, la cantidad de masa de los productos es igual a la cantidad de masa de los reactantes. En este caso, la cantidad de EDTA que se necesita para eliminar todo el plomo en el cuerpo del paciente se calcula utilizando la siguiente ecuación estequiométrica:
Esta ecuación muestra que se necesitan dos moléculas de EDTA para unirse a una molécula de plomo y formar el complejo de Pb(EDTA)2.
Cálculo de la concentración de Plomo en Molaridad:
Cálculo de la concentración de EDTA necesaria:
Esto significa que se necesitan 5.79 x 10-6 mol/L de EDTA para unirse a todo el plomo en la sangre del paciente. La cantidad de EDTA se administró al paciente en una solución intravenosa durante un período de varias horas.
Después del tratamiento con EDTA, se realizó un análisis de sangre para verificar que se hubiera eliminado todo el plomo del cuerpo del paciente. La concentración de plomo en la sangre del paciente después del tratamiento fue de 2 µg/dL, que es una concentración normal. Esto indica que el tratamiento con EDTA fue efectivo en eliminar el exceso de plomo del cuerpo del paciente.
En conclusión, este caso clínico demuestra cómo la estequiometría puede utilizarse en la práctica médica para calcular la dosis adecuada de un medicamento para tratar una intoxicación por plomo. Al calcular la cantidad necesaria de EDTA para unirse a todo el plomo en el cuerpo del paciente, los médicos pudieron asegurarse de que el tratamiento fuera efectivo y seguro.
Misión: Desintoxicación
Ayuda al equipo médico a salvar al paciente intoxicado.
1. El paciente tiene niveles altos de un metal tóxico. ¿Cuál es?


