Instrucciones
Menú General
Usted tiene las siguientes opciones
- Girar cualquier estructura en los ejes x, y, z.
- Cambiar el fondo del visor 3D
Modelos Atómicos
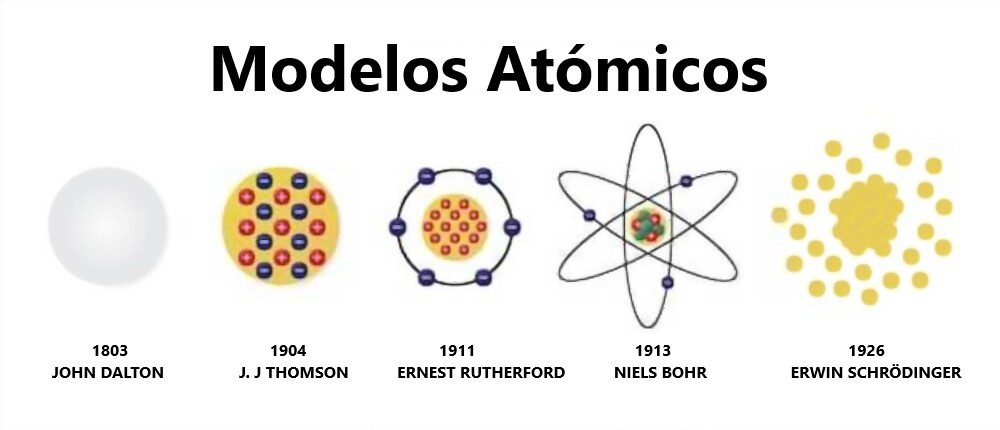
La idea del átomo se remonta a épocas muy lejanas en las cuales todavía no se podía realizar ninguna prueba experimental sobre la existencia del mismo, lo cual dejaba esta idea en algo netamente filosófico. Los primeros en postular una idea sobre el átomo fueron los miembros de la escuela atomista de la antigua Grecia, en un concepto en el cual se decía que los átomos eran un bloque básico e indivisible que compone la materia y el universo.
Leucipo de Mileto
Leucipo de Mileto

Leucipo vivió alrededor del año 450 a.c. y decía que la materia podía ser dividida en partículas cada vez menores, hasta llegar a un límite.
Demócrito

Demócrito
Demócrito, discípulo de Leucipo, vivió alrededor de 470 a 380 a.c. y afirmaba que la materia era discontinua, esto es, la materia era formada por minúsculas partículas indivisibles, las cuales fueron denominadas "de átomo" (que en griego significa indivisible). Demócrito postulo que todos los tipos de materia eran formados a partir de la combinación de los átomos de 4 elementos: agua, aire, tierra y fuego. El modelo de la materia discontinua fue rechazado por uno de los grandes filósofos de la época: Aristóteles, quien afirmaba que la materia era continua, estos es, la materia vista como un "todo entero" (contrastando con la idea de que la materia era constituida por minúsculas partículas indivisibles).
Modelos del átomos
Es el primer modelo atómico con bases científicas, sus postulados son:
- La materia está formada por partículas muy pequeñas llamadas átomos, los cuales son indivisibles y no se pueden destruir.
- Los átomos de elementos iguales tienen características iguales, mientras los átomos de compuestos diferentes tienen características diferentes.
- El átomo nunca se divide, aun cuando se combine en una reacción química.
- Los átomos al combinarse para formar compuestos, mantienen relaciones simples.
- Los átomos de diferentes compuestos se combinan en proporciones y forman más de un compuesto.
- Los compuestos químicos se forman al combinarse átomos de dos o más compuestos.
- Esta teoría tiene dificultades para explicar algunas propiedades del átomo como los rayos catódicos, la electronegatividad ni la presencia de cargas, por esta razón fue descartada y se le dio paso a una nueva teoría.

Modelo de J.J. Thomson
Después del descubrimiento del electrón, en el año 1897 por J.J. Thomson, se determinó que la materia estaba compuesta por dos partes, una negativa y una positiva. La parte negativa eran los recién descubiertos electrones, los cuales mantenían inmersos en una “masa” de carga positiva, de allí que a este modelo se le conoce como el “pudin de pasas”. De este modelo se puede explicar:
- La existencia de los espectros atómicos.
- Algunos fenómenos como la conductividad y la polarización eléctrica.
- Las reacciones químicas bajo el supuesto de intercambio de electrones.
- La periodicidad observada en las propiedades químicas de los compuestos.
- La existencia de iones.
Modelo de Rutherford
Este experimento fue realizado en el año 1909, en los laboratorios de la Universidad de Manchester. La experiencia consistía en “bombardear” una lámina de oro con un haz de partículas alfa y observar cómo las láminas de diferentes metales afectaban a la trayectoria de dichos rayos.
Las partículas alfa se obtenían mediante la desintegración del Polonio.
Según el modelo atómico de Thomson se esperaba que las partículas alfa pasaran la delgada placa de oro sin desviarse mucho de su trayectoria, pero al contrario de eso se observo que un porcentaje de las partículas se devolvieron hacia la fuente de plutonio, "es como si dispararas balas de cañón a una hoja de papel y rebotasen hacia ti" dijo Rutherford.
Rutherford concluyo que el hecho que la mayoría de partículas atravesaran la placa quería decir que gran parte del átomo era vacio, que la desviación de partículas alfa indica que el deflector y las partículas poseen cargas positivas, y el rebote de las partículas era el choque con una zona muy positiva del átomo.
De aquí concluyo Rutherford que el átomo estaba formado por un núcleo y una corteza, el núcleo era la parte positiva y contenía el peso del átomo, mientras que la corteza eran electrones girando alrededor de este núcleo.
Este modelo se agradece al experimento de Rutherford, por medio del cual el señor Ernest Rutherford en el año 1911 dice que el átomo tiene una parte positiva, el núcleo, el cual poseía los Protones (cargas positivas) y Neutrones (Cargas Neutras), llamado Núcleo, el cual contiene toda la masa del átomo, y los electrones giraban alrededor de este núcleo en orbitas circulares y elípticas.
De este modelo atómico se puede concluir que:
- Todos los núcleos de los átomos de un elemento dado tienen la misma carga eléctrica.
- La carga nuclear es un múltiplo entero de valor de la carga del electrón.
- La carga nuclear de un átomo es igual al número atómico químico, el cual determina su posición en la tabla periódica.
- Pero también presentaba varios problemas.
- Contradecía las leyes de Maxwell porque no podía explicar la estabilidad del átomo frente a la emisión de radiación electromagnética debida a la aceleración de los electrones.
- No explicaba los espectros atómicos
Modelo de Bohr

El modelo de Bohr introduce mejoras sustanciales al modelo de Rutherford al incorporar aspectos energéticos
derivados de la energía de Planck y del efecto fotoeléctrico de Einstein.
Modelo de Bohr

Aunque una descripción detallada del modelo de Bohr es compleja, las siguientes son las características más relevantes:
- Los electrones se sitúan en órbitas circulares estables; es decir, donde no emiten energía y no todas están permitidas.
- Las órbitas permitidas de los electrones del modelo atómico de Bohr tienen un momento angular que es un múltiplo que es un múltiplo entero de h/2π (constante de Planck dividido por 2π).
- Los electrones emiten o absorben un fotón o cuanto al cambiar de órbitas atómicas que coincide con la diferencia de energía de las órbitas y no necesitan pasar por estados intermedios.
- En el átomo de Bohr, las órbitas de los electrones siguen las reglas de la Mecánica Clásica pero no así los cambios de órbita.
- Al margen del gran acierto de este modelo en muchos aspectos, el problema del modelo de Bohr y de toda la Mecánica Cuántica es que se van añadiendo supuestos a lo largo de la historia, pero sin explicar las razones que los justifican, únicamente que funcionan y explican mejor la realidad; lo cual, no estando nada mal, no ayuda mucho a la comprensión de la realidad si se apoyan en principios físicos despistantes.
- Bohr introduce mejoras sustanciales al modelo de Rutherford al incorporar aspectos energéticos derivados de la energía de Planck y del efecto fotoeléctrico de Einstein.
- Aunque una descripción detallada del modelo de Bohr es compleja, las siguientes características son relevantes en relación al modelo que va a introducir la Mecánica Global son
- Los electrones se sitúan en órbitas circulares estables; es decir, donde no emiten energía y no todas están permitidas.
- Las órbitas permitidas de los electrones del modelo atómico de Bohr tienen un momento angular que es un múltiplo exacto de de hbar (constante de Planck dividido por 2π).
- Los electrones emiten o absorben un fotón o cuanto al cambiar de órbitas atómicas que coincide con la diferencia de energía de las órbitas y no necesitan pasar por estados intermedios.
- En el átomo de Bohr, las órbitas de los electrones siguen las reglas de la Mecánica Clásica pero no así los cambios de órbita.
Al margen del gran acierto de este modelo en muchos aspectos, el problema del modelo de Bohr y de toda la Mecánica Cuántica es que se van añadiendo supuestos a lo largo de la historia, pero sin explicar las razones que los justifican, únicamente que funcionan y explican mejor la realidad; lo cual, no estando nada mal, no ayuda mucho a la comprensión de la realidad si se apoyan en principios físicos despistantes.
El modelo de Schrödinger (1926) cambia la filosofía de las órbitas seguramente por las nuevas aportaciones a la teoría atómica de De Broglie sobre la naturaleza ondulatoria de la masa en 1924 y describe a los electrones con funciones de onda, que nos permiten obtener la probabilidad de que el electrón se encuentre en un determinado punto del espacio. De esta forma se obtienen de densidad espacial de probabilidad de encontrar un electrón.
Este modelo de átomo de Schrödinger se ajusta mucho mejor a las observaciones; pero, al abandonar la visión anterior sobre la forma de las órbitas se aleja de una explicación intuitiva de las causas de esas órbitas tan caprichosas. Al mismo tiempo, Schrödinger se adentra en el mundo de las probabilidades y de la abstracción matemática que en grandes dosis podría llegar a ser muy perjudicial o negativa.
De acuerdo con la teoría enunciada por Louis de Broglie en 1924 y reconocida actualmente, la materia, en la misma forma que la luz, tiene una naturaleza dual de partículas y de onda. En partículas grandes, la naturaleza ondulatoria de la materia no es apreciable.
Así, por ejemplo, una bola de Beisbol que se mueve con una velocidad de 100 km/hora tiene una longitud de onda de 10-32cm. No obstante, cuando se trata de partículas pequeñas (protones, electrones, etc.), esta naturaleza cobra significado y se vuelve causa importante de muchos resultados.
En 1927, Werner Heisenberg enunció el denominado “Principio de Incertidumbre” que significa que es imposible conocer simultáneamente la posición exacta y el movimiento de un objeto. Cualquier experimento que se diseñe variará una de las dos o ambas propiedades. Así, por ejemplo, aunque intentemos determinar dónde está un electrón en un momento dado (posición), no podemos predecir hacia donde irá después que lo observemos (movimiento). En otras palabras, no se puede fijar con certeza el recorrido de un electrón. Este es el fallo principal de los modelos de Böhr y Sommerfeld, que determinan caminos específicos y orbitas para los electrones.
Basado en los trabajos de De Broglie, Erwin Schrödinger desarrolló en 1926 una ecuación matemática que relaciona las longitudes de onda asociadas a los electrones, con sus energías.
Si bien no podemos conocer el recorrido de los electrones, sí podemos determinar a través de la ecuación de Schrödinger una región del espacio vecina al núcleo donde la probabilidad de hallar cada electrón sea considerable. Esta región se conoce como “Orbital”. Normalmente se entiende el Orbital como la región espacial para la cual la probabilidad de hallar un electrón es de un 90 a 95%. Lógicamente el electrón puede encontrarse en un momento dado fuera del orbital, pero la probabilidad de que esto suceda es de sólo un 5 a un 10 por ciento.
Habíamos visto que un nivel consta de uno o varios subniveles. Del mismo modo, cada subnivel consta de uno o varios orbitales. Los subniveles de clase “S” constan de un solo Orbital; los subniveles “P”, constan de 3; los “D” de 5 y los “f” de 7.
La forma y tamaño de los orbitales dependen de la energía de los electrones que los ocupan. De este modo, la forma de un orbital para un electrón de un subnivel “s” será diferente a la de un electrón de un subnivel “p” o “d”.
Aunque una descripción detallada del modelo de Bohr es compleja, las siguientes características son relevantes en relación al modelo que va a introducir la Mecánica Global son:
- Los electrones se sitúan en órbitas circulares estables; es decir, donde no emiten energía y no todas están permitidas.
- Las órbitas permitidas de los electrones del modelo atómico de Bohr tienen un momento angular que es un múltiplo exacto de de hbar (constante de Planck dividido por 2π).
- Los electrones emiten o absorben un fotón o cuanto al cambiar de órbitas atómicas que coincide con la diferencia de energía de las órbitas y no necesitan pasar por estados intermedios.
- En el átomo de Bohr, las órbitas de los electrones siguen las reglas de la Mecánica Clásica pero no así los cambios de órbita.
- Al margen del gran acierto de este modelo en muchos aspectos, el problema del modelo de Bohr y de toda la Mecánica Cuántica es que se van añadiendo supuestos a lo largo de la historia, pero sin explicar las razones que los justifican, únicamente que funcionan y explican mejor la realidad; lo cual, no estando nada mal, no ayuda mucho a la comprensión de la realidad si se apoyan en principios físicos despistantes.
- Bohr introduce mejoras sustanciales al modelo de Rutherford al incorporar aspectos energéticos derivados de la energía de Planck y del efecto fotoeléctrico de Einstein.
- Aunque una descripción detallada del modelo de Bohr es compleja, las siguientes características son relevantes en relación al modelo que va a introducir la Mecánica Global son
- Los electrones se sitúan en órbitas circulares estables; es decir, donde no emiten energía y no todas están permitidas.
- Las órbitas permitidas de los electrones del modelo atómico de Bohr tienen un momento angular que es un múltiplo exacto de de hbar (constante de Planck dividido por 2π).
- Los electrones emiten o absorben un fotón o cuanto al cambiar de órbitas atómicas que coincide con la diferencia de energía de las órbitas y no necesitan pasar por estados intermedios.
- En el átomo de Bohr, las órbitas de los electrones siguen las reglas de la Mecánica Clásica pero no así los cambios de órbita.
Al margen del gran acierto de este modelo en muchos aspectos, el problema del modelo de Bohr y de toda la Mecánica Cuántica es que se van añadiendo supuestos a lo largo de la historia, pero sin explicar las razones que los justifican, únicamente que funcionan y explican mejor la realidad; lo cual, no estando nada mal, no ayuda mucho a la comprensión de la realidad si se apoyan en principios físicos despistantes.
En la década de los setentas, se propone el "Modelo Estándar", este modelo explica cómo están organizadas las partículas subatómicas y cómo interactúan entre sí gracias a fuerzas fundamentales como la fuerza electromagnética (que mantiene a los electrones cerca del núcleo) y la fuerza nuclear fuerte (que mantiene unidos protones y neutrones en el núcleo).La teoría atómica desarrollada en este tutorial, se fundamenta en cálculos matemáticos complejos de la probabilidad de encontrar un electrón determinado en una región del espacio alrededor del núcleo. Vale la pena entonces ahora aclarar de donde provienen los número que corresponden al nivel de energía (1, 2, 3, 4, etc), por qué hay un número máximo de 2 electrones en el primer nivel de energía, 8 en el segundo, 18 en el tercero, etc.: y finalmente, por que hay solamente un orbital s en un conjunto, 3 orbitales p en otro conjunto y 5 orbitales d en otro conjunto.
Números Cuánticos
Todos estos valores provienen de soluciones de la ecuación de onda. Esta ecuación llamada ecuación de onda de Schrödinger, es una ecuación muy compleja que tiene diferentes soluciones posibles. Cada una de las soluciones permitidas dan un conjunto de tres números cuánticos.
Ecuación de Onda

- El primero es el número cuántico principal (n), el cual está relacionado con el nivel de energía.
- El segundo número cuántico (l), esta relacionado con el subnivel dentro de un nivel de energía determinado.
- El tercero es el número cuántico magnético (ml), el cual esta relacionado con la orientación en el espacio de un orbital en particular.
- El cuarto número cuántico es el número cuántico de spin (ms), que se agregó a los anteriores por el hecho de que en cualquier orbital puede haber 2 electrones con spin opuesto.
Número Cuántico Principal (n)
Puede ser cualquier valor entero positivo desde uno; es decir que existe un conjunto de soluciones a la ecuación de onda para cada valor entero positivo de n. este especifica el nivel de energía y está relacionado con el tamaño de la nube electrónica, o para un grupo de electrones con la distancia al núcleo.
Número Cuántico Secundario (l)
Los valores permitidos para el número cuántico secundario dependen del valor de n; l puede tener cualquier valor entero de 0 hasta (n-1). Por tanto, si n=1, l sólo puede ser 0; si n=2, l puede ser 0 ó 1; si n=3, l puede se 0, 1 ó 2; etc.
El valor de l describe un subnivel específica y determina la forma de la distribución probabilística del electrón.
Número Cuántico Magnético
Dentro de cada subnivel definido por n y l aparecen distintos orbitales, que se diferencian en el valor del tercer número cuántico ml. Este número informa sobre la orientación de la nube electrónica alrededor del núcleo. Los valores de ml van desde –l hasta +l de unidad en unidad: ml = ..., -1, 0, +1, ...,
Números Cuánticos

Números Cuánticos
Número Cuántico de spin ms
Este cuarto número cuántico se agrega para tener en cuenta el spin de los electrones. Este número, no proviene de las soluciones permitidas de la ecuación de onda. Puesto que se ha encontrado que cualquier orbital puede alojar un máximo de dos electrones con spines opuestos, debe haber dos valores posibles de ms (+½ ó -½ ).
El movimiento de cualquier partícula cargada genera un campo magnético. El spin de los electrones puede ser en el sentido de las agujas del reloj (+½ ) o en contra del sentido de las agujas del reloj (-½ ) alrededor de un eje imaginario. El electrón tiene polos magnéticos norte y sur. Estos campos magnéticos se compensan parcialmente para la repulsión eléctrica.
Spin del Electrón

Ejercicio sobre números cuánticos
Calculadora de números cuánticos
Escriba una serie aceptable de cuatro números cuánticos para cada electrón de un átomo de nitrógeno.
Respuesta


Ejercicio sobre números cuánticos
Escriba una serie aceptable de cuatro números cuánticos para cada electrón de un átomo de cloro.
Respuesta


Guía de Estudio
Modelos Atómicos y Números Cuánticos
Quiz (Preguntas de Respuesta Corta)
- ¿Cuál fue la principal limitación del modelo atómico de Dalton que llevó a su eventual descarte?
- Describe brevemente el modelo atómico de Thomson y cómo se le conoce popularmente.
- ¿Cuál fue el resultado inesperado del experimento de la lámina de oro de Rutherford y qué conclusión principal se derivó de él sobre la estructura del átomo?
- ¿Qué mejora fundamental introdujo el modelo atómico de Bohr en comparación con el modelo de Rutherford?
- Menciona una de las principales limitaciones del modelo atómico de Bohr.
- ¿Cuál es la principal diferencia en la descripción de los electrones entre el modelo de Bohr y el modelo de Schrödinger?
- ¿Qué establece el Principio de Incertidumbre de Heisenberg y cómo afecta nuestra comprensión de la trayectoria de un electrón?
- Define brevemente el concepto de "orbital" en el contexto del modelo atómico actual.
- ¿Cuáles son los cuatro números cuánticos y qué propiedad del electrón describe cada uno?
- ¿Qué principio explica por qué un orbital puede contener un máximo de dos electrones?
Clave de Respuestas del Quiz
- La principal limitación del modelo de Dalton fue su incapacidad para explicar la existencia de subpartículas atómicas como los electrones y la presencia de cargas eléctricas dentro del átomo. Tampoco podía explicar fenómenos como los rayos catódicos o la electronegatividad.
- El modelo atómico de Thomson proponía que el átomo era una esfera de carga positiva uniforme en la cual se encontraban incrustados los electrones de carga negativa. Se le conoce popularmente como el modelo del "pudín de pasas".
- El resultado inesperado del experimento de Rutherford fue que algunas partículas alfa rebotaron hacia la fuente, en lugar de atravesar la lámina de oro con pequeñas desviaciones. La principal conclusión fue que la mayor parte de la masa y la carga positiva del átomo se concentraban en un núcleo pequeño y denso.
- El modelo de Bohr introdujo la idea de que los electrones orbitan el núcleo en niveles de energía específicos y cuantificados. También incorporó conceptos de la energía de Planck y el efecto fotoeléctrico de Einstein para explicar la emisión y absorción de energía por los átomos.
- Una de las principales limitaciones del modelo de Bohr era que contradecía las leyes del electromagnetismo de Maxwell al no explicar por qué los electrones en órbita no emitían energía constantemente y colapsaban en el núcleo. Tampoco podía explicar los espectros atómicos de átomos con más de un electrón.
- En el modelo de Bohr, los electrones se describen moviéndose en órbitas circulares definidas con energías fijas, mientras que en el modelo de Schrödinger, los electrones se describen mediante funciones de onda que representan la probabilidad de encontrar un electrón en una región del espacio (orbital).
- El Principio de Incertidumbre de Heisenberg establece que es imposible conocer simultáneamente con precisión absoluta tanto la posición exacta como el momento (y por lo tanto, la velocidad) de una partícula, como un electrón. Esto significa que no podemos definir una trayectoria precisa para los electrones.
- Un orbital es una región del espacio alrededor del núcleo atómico donde existe una alta probabilidad (generalmente del 90-95%) de encontrar un electrón. Se describe mediante soluciones de la ecuación de Schrödinger y tiene formas y tamaños específicos dependiendo de la energía del electrón.
- Los cuatro números cuánticos son: el número cuántico principal (n) que describe el nivel de energía; el número cuántico secundario o azimutal (l) que describe la forma del orbital; el número cuántico magnético (ml) que describe la orientación espacial del orbital; y el número cuántico de spin (ms) que describe el momento angular intrínseco del electrón.
- El principio que explica que un orbital puede contener un máximo de dos electrones es el principio de exclusión de Pauli. Este principio establece que no puede haber dos electrones en un mismo átomo que tengan el mismo conjunto de los cuatro números cuánticos. Por lo tanto, si dos electrones ocupan el mismo orbital (n, l, y ml son iguales), deben tener espines opuestos (+½ y -½).
Preguntas de Ensayo
- Compara y contrasta los modelos atómicos de Thomson y Rutherford, destacando los experimentos clave que llevaron al desarrollo del modelo de Rutherford y las principales diferencias en sus concepciones de la estructura atómica.
- Evalúa el modelo atómico de Bohr como una transición entre la física clásica y la mecánica cuántica. Discute sus aciertos al explicar el espectro del hidrógeno y sus limitaciones al aplicarse a átomos más complejos.
- Explica cómo el desarrollo del modelo atómico actual, basado en la mecánica cuántica y la ecuación de Schrödinger, abordó las limitaciones de los modelos anteriores, particularmente en la descripción del comportamiento y la ubicación de los electrones.
- Describe la importancia de los números cuánticos para comprender la organización de los electrones en los átomos. Explica cómo cada número cuántico restringe las posibles características de un electrón y cómo esto se relaciona con la estructura electrónica de los elementos.
- Discute la evolución de la comprensión de la estructura atómica desde las ideas filosóficas de Demócrito hasta el modelo cuántico actual. Analiza cómo los avances tecnológicos y los descubrimientos experimentales influyeron en la modificación y el reemplazo de los modelos atómicos a lo largo de la historia.
Glosario de Términos Clave
- Átomo
- La unidad básica constituyente de la materia, que consiste en un núcleo central denso rodeado por una nube de electrones cargados negativamente.
- Modelo Atómico
- Una representación conceptual de la estructura y el comportamiento de los átomos, que ha evolucionado a lo largo del tiempo con nuevos descubrimientos científicos.
- Electrón
- Una partícula subatómica con carga eléctrica negativa que orbita el núcleo de un átomo.
- Núcleo
- La parte central densa de un átomo que contiene protones (con carga positiva) y neutrones (sin carga).
- Partícula Alfa
- Un núcleo atómico compuesto por dos protones y dos neutrones, emitido durante la desintegración radiactiva.
- Rayos Catódicos
- Flujos de electrones observados en tubos de vacío, cuyo estudio condujo al descubrimiento del electrón.
- Espectros Atómicos
- Los patrones de longitudes de onda de la luz emitida o absorbida por un átomo, que son únicos para cada elemento.
- Órbita
- En el modelo de Bohr, una trayectoria circular definida alrededor del núcleo en la que se supone que se mueven los electrones con una energía específica.
- Fotón
- Un cuanto de energía electromagnética, considerado como una partícula elemental que es la portadora de la fuerza electromagnética.
- Función de Onda
- Una descripción matemática del estado cuántico de un electrón, cuya magnitud al cuadrado da la probabilidad de encontrar el electrón en una región específica del espacio.
- Orbital
- Una región del espacio alrededor del núcleo atómico donde existe una alta probabilidad de encontrar un electrón, descrito por la mecánica cuántica.
- Número Cuántico Principal (n)
- Un número entero positivo que indica el nivel de energía de un electrón y está relacionado con el tamaño del orbital.
- Número Cuántico Secundario o Azimutal (l)
- Un número entero que va desde 0 hasta n-1 y describe la forma del orbital (s, p, d, f).
- Número Cuántico Magnético (ml)
- Un número entero que va desde -l hasta +l, incluyendo 0, y describe la orientación espacial de un orbital dentro de un subnivel.
- Número Cuántico de Spin (ms)
- Un número cuántico que tiene dos valores posibles (+½ o -½) y describe el momento angular intrínseco de un electrón.
- Principio de Incertidumbre de Heisenberg
- Un principio fundamental de la mecánica cuántica que establece que es imposible conocer simultáneamente con precisión absoluta la posición y el momento de una partícula.
- Principio de Exclusión de Pauli
- Un principio de la mecánica cuántica que establece que no puede haber dos fermiones (como los electrones) en el mismo estado cuántico simultáneamente. En un átomo, esto significa que no dos electrones pueden tener el mismo conjunto de cuatro números cuánticos.