Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.

Introducción a la Química Orgánica

Escuchar Podcast
Haz clic en el botón para cargar y reproducir el audio.
La química orgánica estudia los compuestos del carbono, pero esto resulta a veces difícil de analizar por hay algunos compuestos que también contienen carbono, pero que, por sus propiedades son estudiados por la química inorgánica.
Podríamos decir entonces, que los compuestos orgánicos en general, deben poseer ciertas características que los diferencian de los compuestos inorgánicos.
Diferencias entre Compuestos Orgánicos e Inorgánicos
Selecciona una característica para ver la comparación detallada.
Estructura del átomo de carbono
El carbono es el átomo fundamental de los compuestos orgánicos, cuyas moléculas contienen uno o más átomos de dicho elemento. El carbono tiene la propiedad de unirse entre sí mediante enlaces de tipo covalente, formando cadenas.
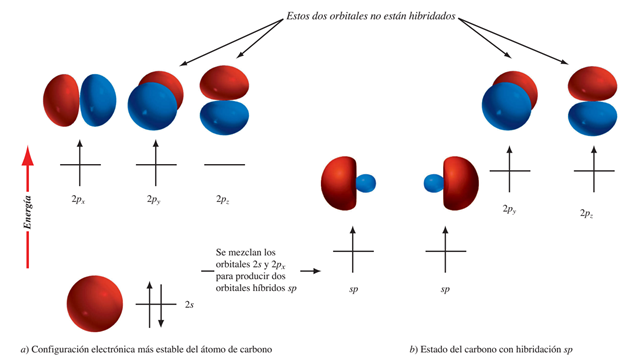
Estado fundamental del carbono
El carbono en su estado fundamental distribuye sus electrones de la siguiente manera: 1s2 2s2 2p2.
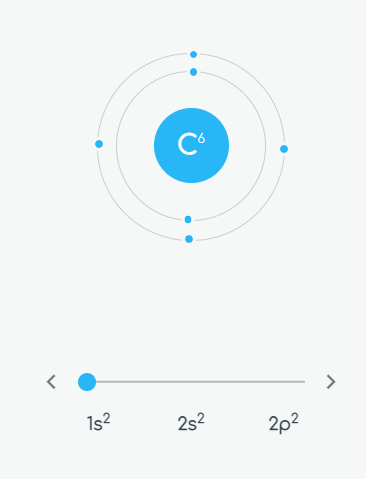
La Regla de Hund afirma que "para cualquier conjunto de orbitales, tal como el caso de los orbitales 2p, se encuentra que hay un electrón en cada orbital antes que haya un apareamiento". En consecuencia los electrones del carbono se distribuyen así.
El carbono muestra en su estado fundamental dos electrones de esta clase y en consecuencia su capacidad de enlace es de dos. Así se comporta cuando forma compuestos como el monóxido de carbono , CO.
Sin embargo, en los compuestos orgánicos, el carbono no forma dos sino cuatro enlaces, lo cual significa que debe poseer cuatro electrones desapareados. ¿Cómo hace el carbono para cumplir tal requisito?
Teoría de la hibridación
Para dar respuesta a la interrogante anterior, el químico Linus Pauling formuló la teoría de la hibridación.
Dicha teoría afirma que: "en el momento de combinarse, los átomos alcanzan un estado de excitación, como consecuencia de la energía que ganan. En tal estado, algunos electrones saltan de un orbital inferior a uno inmediatamente superior".
El estado excitado del carbono
Para el carbono, debemos supones que el electrón del orbital 2s salta al orbital 2pz que en el estado fundamental se encontraba vacío quedando la siguiente estructura .

Esta distribución constituye el estado excitado del carbono. En ella se observan cuatro electrones desapareados que justifican su valencia de cuatro.
Pero queda por aclarar un detalle. Obsérvese que con esta estructura se esperaría la formación de cuatro enlaces, tres de los cuales sería más energéticos que el restante, puesto que los orbitales p son más energéticos que el orbital s. Sin embargo, los resultados experimentales demuestran que los cuatro enlaces que forma el carbono en compuestos como el metano (CH4), por ejemplo, son perfectamente equivalentes. Esto implica que si se trata de romper dichos enlaces, la energía necesaria par hacerlo, es igual en cada uno de ellos. ¿Cómo explicar esta realidad experimental?
Hibridación sp3
La solución para el dilema es aceptar la formación de orbitales híbridos mezclados: el electrón del orbital 2s y los tres electrones de los orbitales 2p, sumarían sus energías y la redistribuirían entre sí por partes iguales. Esto quiere decir que se han formado cuatro orbitales híbridos, cada uno de los cuales lleva una cuarta parte de la característica s (25%) y tres cuartas partes (75%) de la característica p, razón por la que se denominan orbitales híbridos sp3 (otro modelo 3D de un orbital híbrido sp3).
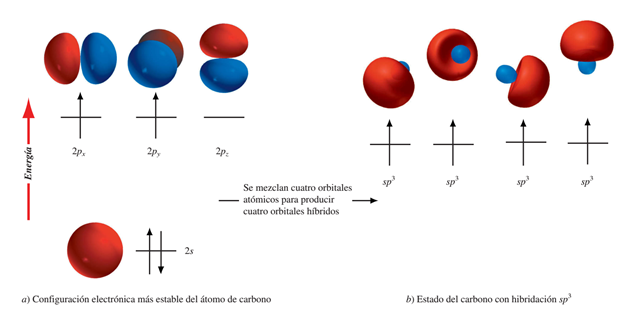
El siguiente modelo sirve para aclarar qué es la hibridación o mezcla. Piénsese en cuatro galones de pintura, de los cuales uno es blanco y tres rojos. Si se desea que todos tengan las mismas características, la solución es mezclarlos o hibridarlos. Al hacerlo, se siguen teniendo los mismos cuatro galones pero ahora ya no son blancos ni rojos sino rosados. Cada uno de ellos contendrá una cuarta parte de blanco y tres cuartas partes de rojo, lo cual podrá escribirse como br3.
Configuración de los orbitales sp3
Así como cambió el color de la pintura, lo que cambia en los orbitales es su energía, y en consecuencia su forma. Recuérdese que los orbitales s tienen forma esférica y los orbitales p poseen forma de ocho; la mezcla o hibridación de los dos origina una forma también de ocho, pero en la cual una mitad es más grande que la otra.
El átomo de carbono tetraédrico
Establecida la forma que presenta un orbital híbrido sp3, conviene examinar qué orientación tienen en el espacio. Los investigadores han establecido que los cuatro orbitales híbridos sp3 del átomo de carbono están dirigidos hacia los cuatro vértices de un tetraedro regular, en cuyo punto central se ubicaría el núcleo del átomo.
Por esta razón la hibridación sp3 también se le conoce con el nombre de hibridación tetraédrica o tetragonal. Obsérvese que el ángulo formado por ello es de 109 grados, 28 minutos.
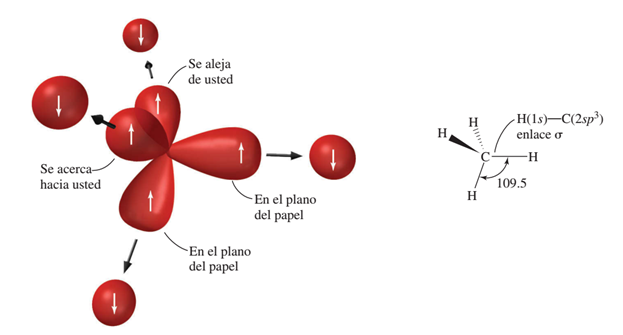
La hibridación tetraédrica le permite al carbono formar enlaces sencillos. Por ejemplo en el metano (CH4), el carbono tiene cuatro electrones disponibles para formar enlaces y cada hidrógeno un electrón. La siguiente animación muestra que cada orbital híbrido sp3 del carbono se superpone con el orbital 1s de cada hidrógeno: el electrón del orbita sp3 se aparea con el electrón del 1s, formando un enlace de tipo covalente simple.
En la siguiente imagen a) se puede observar que los cuatro orbitales sp3 se dirigen hacia los vértices de un tetraedro y hace que cada ángulo de enlace sea de 109.5 grados. En la imagen b) de los orbitales del metano donde se ve el traslape de cada orbital sp3 del carbono con el orbital s de un hidrógeno. (Por claridad, no se muestran los lóbulos menores de los orbitales sp3).
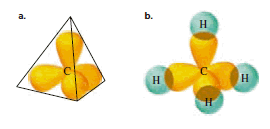
El enlace σ
El enlace sigma es el formado por la superposición de la cabeza de los orbitales y se caracteriza por su baja energía; sólo puede existir una unión sigma entre un átomo y otro. Existe libertad de rotación alrededor de cada enlace simple carbono-carbono a no ser que ambos átomos estén unidos a grupos muy voluminosos o cargados, en cuyo caso la rotación queda restringida.
Entre más átomos de carbono existan en la molécula, se da una mayor posibilidad de rotaciones a lo largo de toda la estructura, lo que genera muchas conformaciones.
Aquí observamos todas las conformaciones que pueden existir en el .
¡Atención!
Simulador de hibridación sp3
Hibridación sp2
Cada uno de los átomos de carbono en el (al que también se le llama etileno) forma cuatro enlaces, pero sólo está unido a tres átomos:
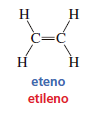
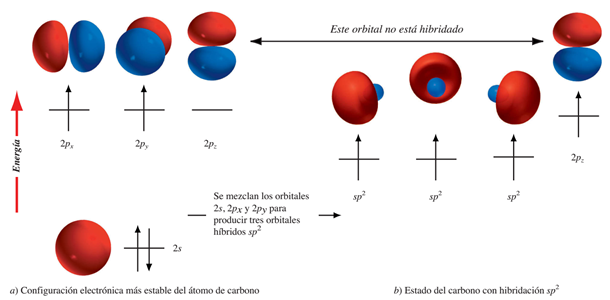
Para enlazarse con tres átomos, cada carbono combina tres orbitales atómicos: un orbital s y dos de los orbitales p. Como se combinan tres orbitales se obtienen tres orbitales híbridos, a los que se les llama orbitales sp2 y un orbital p puro:

Los alquenos son hidrocarburos cuyas moléculas contienen doble enlace carbono-carbono. Como todos sus carbonos no están saturados con átomos de hidrógeno se denominan hidrocarburos insaturados u olefinas. Los átomos de carbono que poseen el doble enlace tienen hibridación sp2 o trigonal.
En la hibridación sp2 producida a partir del estado excitado del carbono, como su nombre lo indica, la combinación se realiza entre un orbital s y dos orbitales p, conservando el tercero de éstos su forma pura.
Los tres orbitales sp2 del carbono ( modelo 3D de un orbital híbrido sp2) se disponen sobre un mismo plano a la manera de hoja de trébol, formando entre sí ángulos de 120°.
El orbital p sobrante cae en un plano perpendicular al anterior, situando una mitad por encima y la otra por debajo del mismo.
¡Atención!
Simulador de hibridación sp2
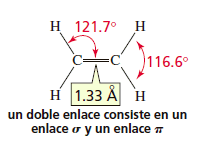
La hibridación sp2 es propia de los átomos de carbono que forman doble enlace, tal como ocurre en el etileno (CH2=CH2).
Para la formación de dicha molécula, un orbital híbrido sp2 del primer carbono se superpone con otro orbital híbrido sp2 del segundo carbono, formando un enlace σ. Los orbitales p de cada átomo quedan paralelos entre sí, formando un nuevo enlace llamado π. Estos son energéticamente más débiles que los sigma, pero al ubicarse por encima y debajo del plano, impiden la rotación de los átomos.
Los orbitales sp2 tienen la misma forma de los sp3 pero son más pequeños. Por lo tanto el doble enlace es más corto ( 1.33 Å) que el enlace sencillo ( 1.53-1.54 Å).
Finalmene, la molécula de eteno queda conformada por los enlaces que se forman entre los orbitales sp2 sobrantes y los orbitales s de los hidrógenos.
Hibridación sp
Cada uno de los átomos de carbono del (llamado también acetileno) está enlazado a sólo dos átomos: uno de hidrógeno y otro de carbono:
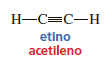
Como cada carbono forma enlaces covalentes con dos átomos, sólo están hibridados dos orbitales de cada carbono; uno s y uno p. El resultado son dos orbitales híbridos degenerados sp (modelo 3D de un orbital híbrido sp). Por consiguiente, cada átomo de carbono del etino tiene dos orbitales sp y dos orbitales p puros.
¡Atención!
Simulador de hibridación sp
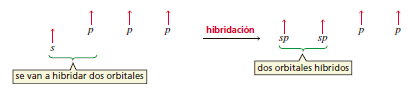
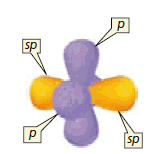
Para minimizar la repulsión electrónica, los dos orbitales sp apuntan en direcciones opuestas.
Los átomos de carbono del etino se mantienen unidos por tres enlaces. A tres enlaces que unen dos átomos se les llama enlace triple. Uno de los orbitales sp de cada carbono se traslapa con el orbital s de un hidrógeno para forma un enlace σ C-H (figura a)
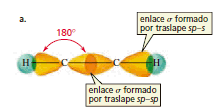
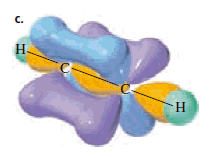
Como los dos orbitales sp apuntan en direcciones opuestas, los ángulos de enlace son de 180 grados. Los dos orbitales p puros son perpendiculares entre sí y también son perpendiculares a los orbitales sp. Cada uno de los orbitales p puros se acopla en un traslape lateral con un orbital p paralelo del otro carbono y el resultado es que se forman dos enlace p (figura b).
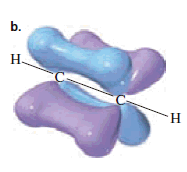
Por lo anterior, un triple enlace consiste en un enlace σ y dos enlaces π. Los dos orbitales p puros de cada carbono son perpendiculares entre sí y crean regiones de alta densidad electrónica arriba y abajo y también adelante y atrás del eje internuclear de la molécula (figura c).
Simulación de Hibridación del Carbono
Modo: sp³
Guía de Estudio
Estudio Detallado de la Hibridación del Carbono
Quiz de Hibridación del Carbono
Instrucciones: Haz clic en cada pregunta para revelar la respuesta.
La distribución electrónica del carbono en su estado fundamental es 1s² 2s² 2p². Con dos electrones desapareados en los orbitales 2p, se esperaría que formara dos enlaces, como en el monóxido de carbono.
La teoría de la hibridación postula que, al combinarse, el carbono alcanza un estado de excitación donde un electrón del orbital 2s salta a un orbital 2pz vacío, resultando en cuatro electrones desapareados que justifican su valencia de cuatro.
En la hibridación sp³, el orbital 2s y los tres orbitales 2p del carbono mezclan sus energías para formar cuatro orbitales híbridos equivalentes. Cada orbital híbrido sp³ tiene un 25% de característica s y un 75% de característica p.
Un átomo de carbono con hibridación sp³ tiene una disposición tetraédrica de sus orbitales, dirigidos hacia los vértices de un tetraedro regular. El ángulo formado por estos orbitales es de aproximadamente 109.5 grados.
Un enlace sigma (σ) se forma por la superposición frontal o "cabeza con cabeza" de orbitales atómicos, ya sean puros o híbridos. Se caracteriza por ser un enlace de baja energía y solo puede existir una unión sigma entre dos átomos dados.
Los átomos de carbono que forman un doble enlace tienen hibridación sp². Para lograr esta hibridación, un orbital s y dos de los orbitales p se combinan.
Los tres orbitales híbridos sp² se disponen en un mismo plano, formando ángulos de 120°. El orbital p puro restante es perpendicular a este plano.
En el etileno (CH₂=CH₂), un doble enlace se forma por la superposición de un orbital sp² de cada carbono (enlace σ) y el traslape lateral de los orbitales p puros (enlace π).
Los átomos de carbono que forman un triple enlace tienen hibridación sp. Para lograrlo, un orbital s y un orbital p se combinan.
Un triple enlace consiste en un enlace sigma (σ) y dos enlaces pi (π). Los dos orbitales híbridos sp apuntan en direcciones opuestas (180°), mientras que los dos orbitales p puros se superponen lateralmente.