Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.

Introducción a la Química Orgánica

Escuchar Podcast
Haz clic en el botón para cargar y reproducir el audio.
Polaridad de las Moléculas
La mayoría de enlaces químicos son polares, por lo que las moléculas que los contienen también son polares. La polaridad de una molécula es el resultado de la suma vectorial de todas las polaridades de todos los enlaces presentes en una molécula y también la contribución de los electrones libres. Normalmente, todos las moléculas que son fuertemente polares son solubles en solventes polares como el agua, en tanto que las sustancias no polares normalmente no son solubles en agua.
Para poder comprender el momento dipolar, suponga que hay un centro de masa de todas las cargas positivas (núcleos), en una molécula y un centro de masa de todas las cargas negativas (electrones), si estos dos centros no coinciden, entonces la molécula tiene una polaridad neta. El momento dipolar, μ (letra griega mu), se define como la magnitud de la carga Q en cualquier extremo del dipolo molecular, multiplicada por la distancia r entre las cargas, μ = Q x r. Los momentos dipolares se expresan en debyes (D), donde 1 D = 3.336 x 10-30 coulomb metro (C . m) en unidades del SI; por ejemplo, la unidad de carga en un electrón es de 1.60 x 10-19C, por tanto, si una carga positiva y una carga negativa estuvieran separadas por 100 pm (un poco menos que la longitud de un enlace covalente promedio), el momento dipolar sería 1.60 x 10-29 C x m o 4.80 D.
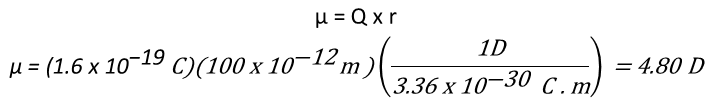
En todos los enlaces covalente hay compartición de electrones, estos se diferencia por el grado de compartición. Los enlaces covalentes se clasifican en dos categorías —covalente no polar y covalente polar— dependiendo de la diferencia en electronegatividad entre los dos átomos enlazados. En un enlace covalente no polar, los electrones son compartidos por igual. En un enlace covalente polar, son compartidos en forma desigual.
Un enlace covalente entre carbono e hidrógeno, por ejemplo, es clasificado como covalente no polar porque la diferencia de electronegatividad entre estos dos átomos es 2.5 - 2.1 = 0.4 unidades. Un ejemplo de un enlace covalente polar es el formado entre H y Cl. La diferencia en electronegatividad entre los dos átomos es 3.0 - 2.1 = 0.9 unidades.
Una consecuencia importante de la forma desigual de compartir electrones en un enlace covalente polar es que el átomo más electronegativo gana una mayor fracción de los electrones compartidos y adquiere una carga parcialmente negativa, lo que indicamos con la letra δ- (delta negativo). El átomo menos electronegativo tiene una menor fracción de los electrones compartidos y adquiere una carga parcial positiva, lo que se indica con el símbolo δ+ (delta positivo). Esta separación de carga produce un dipolo (dos polos). Se puede mostrar la presencia de este dipolo con una flecha , con la punta de la flecha cerca del lado más negativo del dipolo y una cruz en la cola de la flecha cerca de extremo más positivo.
Cloruro de hidrógeno
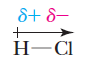
Dipolo eléctrico del HCl
Dipolo eléctrico del HCl 3D
¡Atención!
Simulador de polaridad y orbitales del HCl
Se puede mostrar la polaridad de un enlace covalente por medio de un modelo llamado de densidad electrónica. En este tipo de modelo, el color azul muestra la presencia de una carga δ+ y el color rojo muestra la presencia de una carga δ-. (en el simulador, dar clic en "mostrar/ocultar PEM").
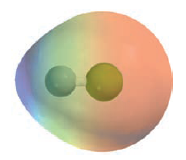
Mapa de potencial electrostático del HCl
¿Como predecir la polaridad de una molécula?
Una molécula será polar si:
- si tiene enlaces polares y
- si la suma vectorial de sus dipolos de enlace no es igual a cero (si los enlaces son polares pero se anulan mutuamente, es no polar).
Dióxido de carbono
Consideremos de ejemplo el dióxido de carbono, CO2, una molécula con dos dobles enlaces polares carbono-oxígeno. Como esta molécula es lineal, la suma vectorial de sus dipolos de enlace es cero, así la molécula es no polar.
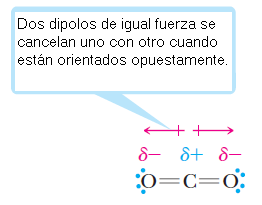
El dióxido de carbono es una molécula no polar
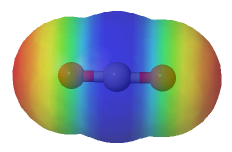
Mapa de potencial electrostático del CO2
¡Atención!
Simulador de polaridad y orbitales del CO2
Agua
En una molécula de agua, cada enlace O—H es polar, con el oxígeno, el átomo más electronegativo, llevando una carga parcial negativa y cada hidrógeno llevando una carga parcial positiva. Porque la molécula de agua en una molécula en forma de V, el centro de su carga parcial positiva está entre los dos átomos de hidrógeno, y el centro de su carga parcial negativa está en el oxígeno. Así, el agua tiene enlaces polares y, debido a su geometría, es una molécula polar.
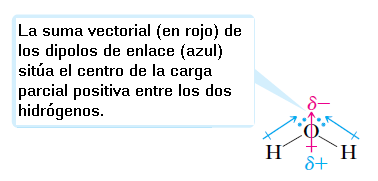
El agua es una molécula polar
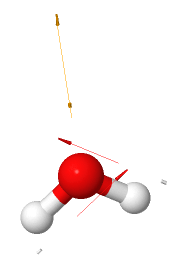
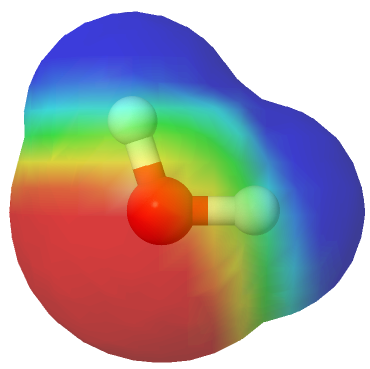
Mapa de potencial electrostático del agua
¡Atención!
Simulador de polaridad y orbitales del H2O
Amoniaco
El amoniaco tiene tres enlaces polares N—H, y debido a su geometría, la suma vectorial de sus dipolos de enlace no es igual a cero. El amoniaco es una molécula polar.
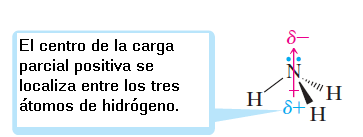
El amoniaco es una molécula polar
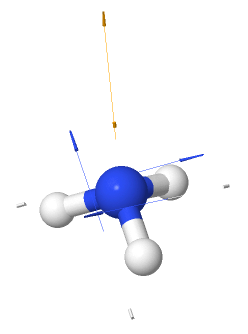
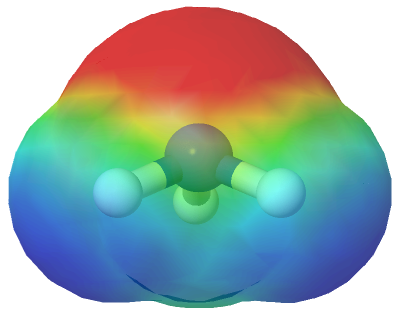
Mapa de potencial electrostático del amoniaco
¡Atención!
Simulador de polaridad y orbitales del NH3
Clorometano CH3Cl
El clorometano (CH3Cl) también es una molécula polar, esto se debe a la presencia del átomo de cloro, por lo que tiene un momento dipolar resultante.
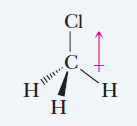
El clorometano es una molécula polar
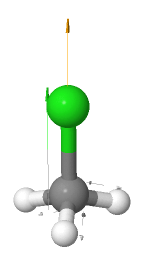
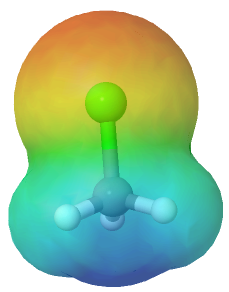
Mapa de potencial electrostático del clorometano
¡Atención!
Simulador de polaridad y orbitales CH3Cl
Diclorometano (CH2Cl2)
El diclorometano (CH2Cl2)también es una molécula polar, pero menos polar que el clorometano.
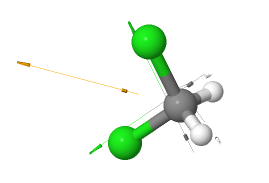
El diclorometano es una molécula polar
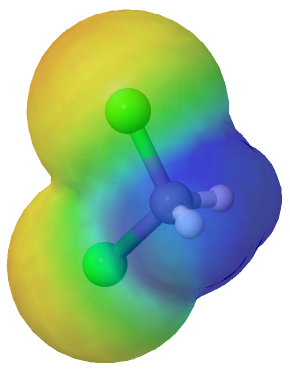
Mapa de potencial electrostático del diclorometano
¡Atención!
Simulador de polaridad y orbitales del CH2Cl2
Triclorometano (CHCl3)
El triclorometano (CHCl3, conocido como cloroformo utilizado como anestésico) también es una molécula polar, pero menos polar que el clorometano y el diclorometano.
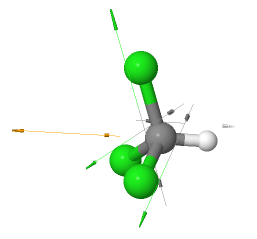
El triclorometano es una molécula polar
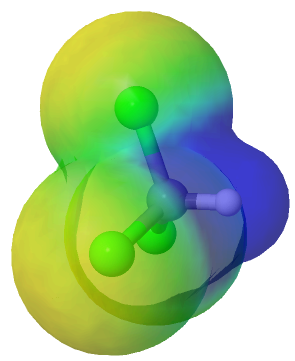
Mapa de potencial electrostático del triclorometano
¡Atención!
Simulador de polaridad y orbitales del CHCl3
Tetracloruro de Carbono (CCl4)
En la molécula de tetracloruro de carbono se da una situación parecida a la molécula de dióxido de carbono, y es que a pesar de tener cuatro enlaces polares C—Cl, por la simetría tetraédrica, los momentos dipolares se anulan dando un momento dipolar de cero, por lo que la molécula es no polar.
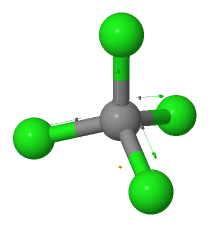
El tetracloruro de carbono es una molécula no polar
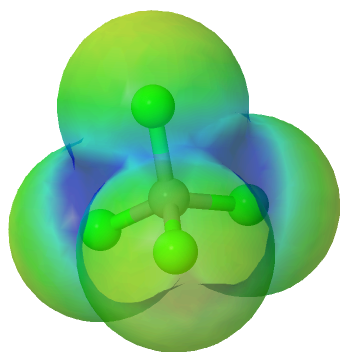
Mapa de potencial electrostático del tetracloruro de carbono
¡Atención!
Simulador de polaridad y orbitales del CCl4
Tabla de resumen de las polaridades de las moléculas estudiadas:
| Molécula | Momento dipolar en Debyes |
|---|---|
| Cloruro de hidrógeno | 1.76 |
| Dióxido de carbono | 0.00 |
| Agua | 1.88 |
| Amoniaco | 1.63 |
| Clorometano | 1.89 |
| Diclorometano | 1.60 |
| Triclorometano (cloroformo) | 1.04 |
| Tetracloruro de carbono | 0.00 |
Simulador de Polaridad Molecular 3D
Explora la polaridad con modelos 3D interactivos y momentos dipolares medidos.
Controles
FÓRMULA:
GEOMETRÍA 3D:
POLARIDAD:
MOMENTO DIPOLAR (Medido):
Guía de Estudio
Polaridad Molecular
Guía de Estudio Interactiva
Quiz Corto
Instrucciones: Responda cada pregunta en 2-3 oraciones.
1. ¿Qué determina si un enlace covalente es polar o no polar?
2. ¿Cómo se representa la carga parcial en un átomo dentro de un enlace covalente polar?
3. Defina momento dipolar (μ) y explique cómo se calcula conceptualmente.
4. ¿Qué unidad se utiliza para expresar el momento dipolar y cuál es su equivalente en unidades del SI?
5. Explique la relación general entre la polaridad de una molécula y su solubilidad en agua.
6. Aunque el dióxido de carbono (CO2) tiene enlaces polares C=O, ¿por qué se clasifica como una molécula no polar?
7. Describa por qué la molécula de agua (H2O) es polar a pesar de tener solo dos enlaces polares O-H.
8. ¿Cómo se representa visualmente la distribución de carga en una molécula usando un mapa de potencial electrostático (PEM)?
9. Compare la polaridad de CH3Cl, CH2Cl2 y CHCl3 basándose en la información proporcionada en el texto.
10. Explique por qué el tetracloruro de carbono (CCl4) es una molécula no polar a pesar de tener cuatro enlaces polares C-Cl.
Preguntas en Formato de Ensayo
Sugerencia: Concéntrese en cómo la simetría de la molécula afecta el resultado final. Explique por qué la forma lineal del CO2 causa que los dipolos de enlace se cancelen, mientras que la forma angular (en V) del H2O permite que se sumen, creando un dipolo neto.
Sugerencia: Comience definiendo la electronegatividad. Luego, explique que una diferencia significativa en la electronegatividad entre dos átomos lleva a un reparto desigual de electrones, lo que crea las cargas parciales δ+ y δ- y, por lo tanto, un dipolo de enlace.
Sugerencia: Trate los dipolos de enlace como vectores (flechas con magnitud y dirección). La polaridad de la molécula depende de la suma neta de estos vectores. Si se cancelan mutuamente debido a la simetría, el momento dipolar neto es cero.
Sugerencia: Analice cómo la sustitución de átomos de H por átomos de Cl (más electronegativos) afecta la suma vectorial total de los dipolos de enlace. Considere que la alta simetría del CCl4 es la razón por la que su momento dipolar es cero, a diferencia de los otros compuestos.
Sugerencia: Comience con la regla de oro "lo similar disuelve a lo similar". Explique que el agua es un solvente polar y, por lo tanto, disuelve eficazmente otros solutos polares (como la sal o el azúcar) porque sus cargas parciales pueden interactuar. Por el contrario, no puede disolver solutos no polares (como el aceite).