Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Cargas parciales, para ver el valor de la carga relativa positiva o negativa de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Equilibrio Químico
El concepto de equilibrio es fundamental para conocer y entender la química y el comportamiento de las sustancias. En la constante de equilibrio se refleja la tendencia que tienen las sustancias de reaccionar, así como también, la dirección y magnitud del cambio químico. Todas las reacciones químicas pueden ser descritas bajo una condición de equilibrio.
Todos los sistemas químicos alcanzan en el tiempo la condición de equilibrio. El estado de equilibrio químico es de naturaleza dinámica y no estática.
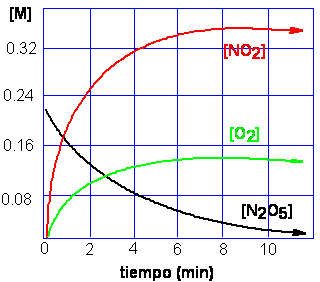
Cuando se coloca en un recipiente de volumen conocido a temperatura constante una muestra de N2O5(g), éste se descompone:
2N2O5(g) → 4NO2(g) + O2(g)
Cuando la concentración de los productos aumenta los mismos se convierten en reactantes:
4NO2(g) + O2(g) → 2N2O5(g)
Finalmente, las dos reacciones evolucionan de modo tal que sus velocidades se igualan, estableciéndose un equilibrio químico.
2N2O5(g) ⇋ 4NO2(g) + O2(g)
¡Atención!
Uso de doble flecha (⇋)
En una reacción reversible, la reacción ocurre simultáneamente en ambas direcciones. Lo anterior se indica por medio de una doble flecha.
Reversibilidad
En principio todas las reacciones químicas son reversibles.
Constante de Equilibrio
Una vez alcanzado el equilibrio las concentraciones de reactantes y productos no cambian en el tiempo. El equilibrio dinámico establece que a medida que el reactante se descompone, los productos se combinan entre sí para mantener las concentraciones constantes, las cuales se relacionan en la siguiente ecuación (productos en el numerador, reactivos en el denominador: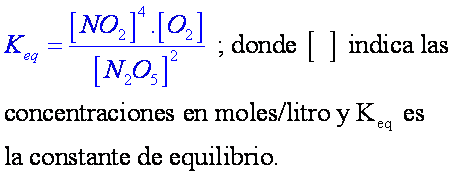
Ley de Acción de Masas
La experiencia ha demostrado que cada reacción en particular presenta su propio estado de equilibrio, caracterizado por una relación específica entre las concentraciones de las diversas sustancias que intervienen en el proceso.
Estas observaciones fueron la base para la formulación de la ley de acción de masas, la cual se enuncia en los siguientes términos: la velocidad de una reacción química es proporcional al producto de las masas activas de las sustancias reaccionantes. La expresión masas activas hace referencia a las concentraciones de las sustancias que participan en la reacción. Recordemos que esta ley es la base para la formulación de la ecuación de velocidad. Cuando se presenta un estado de equilibrio, la ley de acción de masas relaciona las velocidades en los sentidos, directo (reactivos a productos) e inverso (productos a reactivos).
Equilibrio de reacción de descomposición N2O4
En el equilibrio, el N2O4 reacciona para formar una determinada cantidad NO2(g), y esta misma cantidad de NO2(g) reacciona para volver a formar N2O4(g).
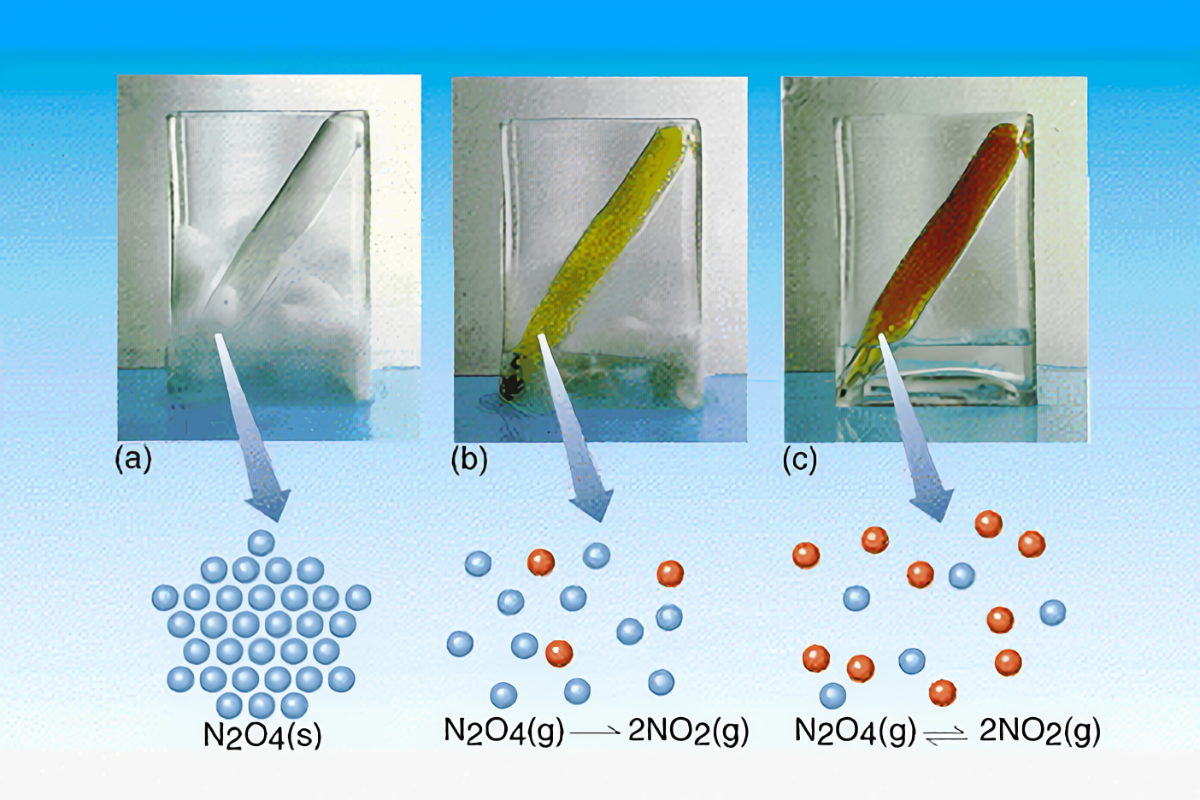
El punto en el cual la velocidad de descomposición:
es igual a la velocidad de dimerización:
es un equilibrio dinámico.
El equilibrio es dinámico porque la reacción no ha parado: Las velocidades de los dos procesos son iguales. En el equilibrio, el N2O4(g) reacciona para formar una determinada cantidad NO2(g), y esta misma cantidad de NO2(g) reacciona para volver a formar N2O4(g).
Definición
El equilibrio químico es el punto en el cual la velocidad de la reacción directa es igual a la velocidad de la reacción inversa. Bajo condiciones adecuadas, el N2 y el H2 reaccionan para formar NH3:
y el NH3 se descompone en N2 y H2
la reacción es reversible y se puede escribir como:
Reacciones Reversibles y Equilibrio Químico
Considere una ecuación hipotética reversible:
que bien podría ser:
al disminuir la concentración de A2(g) la velocidad de la reacción hacia la derecha disminuye. Al comienzo de la reacción no puede ocurrir la reacción inversa sino hasta que se ha formado alguna cantidad de AB. La reacción inversa comienza lentamente (puesto que [AB] es baja y se acelera gradualmente).
A medida que pasa el tiempo, la velocidad de la reacción hacia la derecha disminuye y aumenta la velocidad de la reacción inversa hasta que las dos son iguales y se establece un equilibrio químico. En el equilibrio, las concentraciones de todas las sustancias permanecen constantes debido a que las velocidades de las reacciones opuestas son iguales y no debido a que ha cesado toda actividad.
Si se supone que las reacciones hacia la derecha y hacia la inversa se realizan por mecanismos sencillos de una sola etapa, se obtiene la ecuación de la constante de equilibrio:
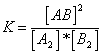
La constante de equilibrio K (Q) varía con la temperatura.
En general, para cualquier reacción reversible:
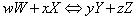
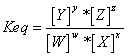
y para la reacción inversa: