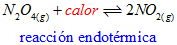Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
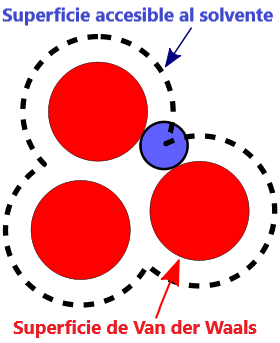
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Cargas parciales, para ver el valor de la carga relativa positiva o negativa de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Equilibrio Químico
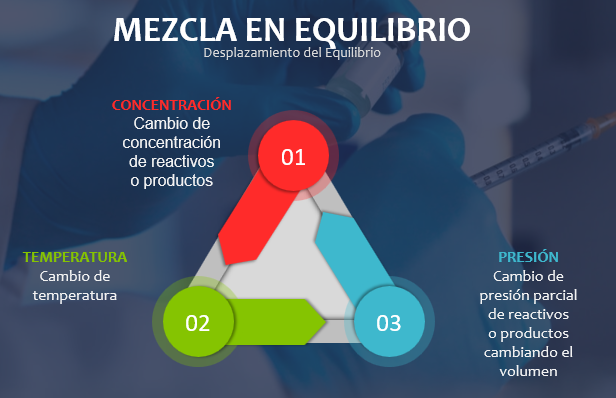
De los factores que afectan la velocidad de una reacción, solamente alteran el punto de equilibrio de dicha reacción: la concentración de las sustancias involucradas en la reacción, la presión, cuando reactivos y productos son gases y la temperatura.
Principio de Le Châtelier
A finales del siglo XIX, el químico francés Henry le Châtelier (1850- 1936) postuló que cuando en un sistema en equilibrio se modifica cualquiera de los factores mencionados, se afecta la velocidad de la reacción y el punto de equilibrio se desplaza en la dirección que tienda a contrarrestar el efecto primario de dicha alteración.
Concentración
Cuando la concentración de una de las sustancias en un sistema en equilibrio se cambia, el equilibrio varía de tal forma que pueda compensar este cambio.
Por ejemplo, si se aumenta la concentración de uno de los reaccionantes, el equilibrio se desplaza hacia la derecha o hacia el lado de los productos.
Si se agrega más reactivos (como agregar agua en el lado izquierdo del tubo) la reacción se desplazará hacia la derecha hasta que se restablezca el equilibrio.
Si se remueven los productos (como quitar agua del lado derecho del tubo) La reacción se desplazará hacia la derecha hasta que se restablezca el equilibrio.

Analogía de aumentar la concentración de algún reactivo, el equilibrio se desplaza hacia la derecha, las concentraciones de productos aumentan y de los reactivos disminuyen.
Analogía de disminuir la concentración de algún reactivo, el equilibrio se desplaza hacia la izquierda, las concentraciones de reactivos aumentan y de los productos disminuyen.
Analogía de aumentar la concentración de algún producto, el equilibrio se desplaza hacia la izquierda, las concentraciones de reactivos aumentan y de los productos disminuyen.
Analogía de disminuir la concentración de algún producto, el equilibrio se desplaza hacia la derecha, las concentraciones de productos aumentan y de los reactivos disminuyen.
Equilibrio Químico en Solución
Cuando el Fe+3 y SCN- se combinan, se establece el equilibrio homogéneo entre ambos iones y el ión FeSCN+2 .Para poder calcular la Keq de la reacción, es necesario conocer las concentraciones de todos los iones en el equilibrio
¡Atención!
Equilibrio Homogéneo en Solución Acuosa
Temperatura
La variación de equilibrio causada por un cambio de temperatura dependerá de si la reacción tal como esta escrita es exotérmica, o endotérmica.
Reacciones Exotérmicas
Si la reacción es exotérmica se puede considerar al calor como uno de los productos, por lo que al aumentar la temperatura el equilibrio se desplaza hacia la izquierda.
Si se disminuye la temperatura, el equilibrio se desplazará hacia la derecha.
Reacciones Endotérmicas
Si la reacción es endotérmica, el calor se considera como un reactivo.
Por lo tanto, si se aumenta la temperatura se favorece un desplazamiento del equilibrio hacia la derecha y si se disminuye, hacia la izquierda.
Presión
Si se aumenta la presión de un sistema en equilibrio, el equilibrio se desplazará de forma que disminuya el volumen lo máximo posible, es decir, en el sentido que alivie la presión. Como ejemplo, considérese el efecto de triplicar la presión en el siguiente equilibrio:
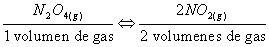
Al existir dos volúmenes de gas del lado de los productos, implica que hay una mayor cantidad de moléculas de NO2 y al aumentar la presión se favorece un mayor número de colisiones entre moléculas en el lado de los productos, por lo que el equilibrio se desplaza hacia la izquierda.
VComo conclusión a este experimento, observe la siguiente película en donde se confina NO2(g) en una jeringa y se puede observar el cambio de color entre este gas y el N2O4(g) formado.
Para comprender mejor el principio de Le Châtelier en cuanto a las variaciones de concentración, presión (volumen) y temperatura, utilice el siguiente simulador (considere que la reacción es endotérmica).