Instrucciones
Cargar archivo PDB
Diferentes formas de representación de las moléculas
- "Amino" es un esquema que asigna colores a los aminoácidos en función de sus propiedades químicas, p. ácido, básico, hidrofóbico o polar. Los colores son ASP, GLU, CYS, MET, LYS, ARG, SER, THR, PHE, TYR, ASN, GLN, GLY, LEU, VAL, ILE, ALA, TRP, HIS y PRO. Los ácidos nucleicos son de color caré claro en el esquema "amino".
- "Cadena" es un esquema que da un color diferente a cada cadena del archivo pdb.
- "Grupo" es un esquema que colorea las cadenas de proteínas de manera diferencial en la dirección amino-carboxi. Este esquema también colorea las cadenas de ácido nucleico de manera diferencial en la dirección 5 '> 3'.
- "Temperatura" es un esquema que colorea los átomos de acuerdo con sus temperaturas anisotrópicas, almacenadas como un valor beta en un archivo pdb. La temperatura anisotrópica indica la movilidad de un átomo o la incertidumbre de posición. Los segmentos más "móviles" y más cálidos son de color rojo, progresando a fragmentos azules más inmóviles.
- "Estructura" es un esquema de color muy útil porque colorea de manera diferencial la estructura secundaria de una proteína (hélices α y láminas β). Es mejor usar un comando de visualización que ilustre la estructura secundaria cuando se utiliza el esquema de colores de la estructura (por ejemplo, cintas, dibujos animados, esqueleto, trazas o hebras; consulte la sección Visualización).
Clasificación de los aminoácidos
- Ácidos: Asp, Glu
- No cíclicos
- Alifáticos: Ala, Gly, Ile, Leu, Val
- Aromáticos: His, Phe, Trp, Tyr
- Básicos: Arg, His, Lys
- Interiores: Ala, Leu, Val, Ile, Phe, Cys, Met, Trp
- Con carga: Asp, Glu, Arg, His, Lys
- Hidrofóbicos: Ala, Leu, Val, Ile, Pro, Phe, Met, Trp
- Polares: Cys, Gly, Ser, Thr, Lys, Asp, Asn, Glu, Arg, Gln, Tyr, His
- Pequeños: Ala, Gly, Ser
Metales
Grupos Prostéticos
Superficie y Cavidades
Sección
Equilibrio Químico
La cinética química es el estudio de las velocidades de las reacciones químicas y de los factores que influyen en ellas. La velocidad de reacción es una medida de la rapidez con que se forman los productos a partir de los reactantes. Algunas reacciones ocurren casi instantáneamente. En estas reacciones, con sólo ponerse en contacto los reactantes se transforman totalmente en productos. Las explosiones son ejemplos de reacciones inmediatas. Otras reacciones tienen velocidades tan lentas que pueden pasar años antes de que la reacción se complete. La mayoría de las reacciones químicas suceden a velocidades intermedias entre estos dos extremos.
Las velocidades de las reacciones químicas se miden, por la determinación de la disminución de la concentración de los reactantes, o del aumento de concentración de los productos, en un intervalo de tiempo específico.
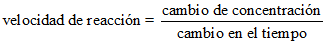
En una reacción con una velocidad de reacción alta, el intervalo de tiempo para que ocurra dicha reacción es relativamente corto. Una reacción que se efectúa a velocidades menores, requiere más tiempo para realizarse.
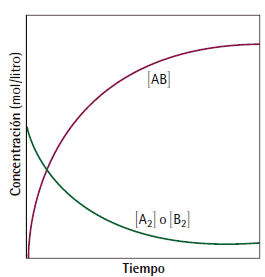
Varación de las concentraciones con el tiempo
Teoría Cinético Molecular
La teoría cinética de los gases explica las características y propiedades de la materia en general, y establece que el calor y el movimiento están relacionados, que las partículas de toda materia están en movimiento hasta cierto punto y que el calor es una señal de este movimiento.
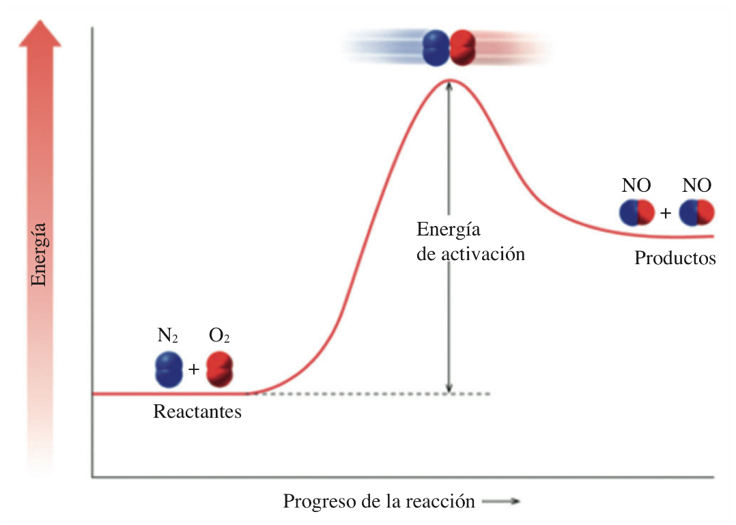
Las velocidades de las reacciones químicas se explican teóricamente por la teoría de las colisiones. La premisa básica de la teoría de las colisiones es que para que dos sustancias reaccionen, las partículas deben chocar entre sí. Después del choque, existen dos posibilidades: se rompen los enlaces en las moléculas de los reactantes y se forman los enlaces en los productos, la colisión se llama colisión efectiva (sólo se observa una colisión efectiva), y si la colisión no genera productos, laa colisión se denomina colisión inefectiva.
Una reacción química tiene lugar cuando:
- Las colisiones entre moléculas tienen energía suficiente para romper los enlaces en los reactivos.
- Se rompen los enlaces entre átomos de los reactivos (N2 y O2) y pueden formarse nuevos enlaces.

Energía de Activación
La energía de activación es la energía mínima necesaria para que tenga lugar una reacción. Cuando una colisión suministra energía igual o superior a la energía de activación, el producto puede formarse.
¡Atención!
Simulador de Equilibrio Químico
Conceptos Básicos
Las leyes de los gases desarrolladas por Boyle, Charles, y Gay-Lussac están basadas en observaciones empíricas y describen el comportamiento de un gas en términos macroscópicos, es decir, en términos de propiedades que una persona puede observar y experimentar directamente. Otra posibilidad de comprender el comportamiento de los gases es por medio de la teoría atómica, que indica que todas las sustancias están compuestas de un gran número de pequeñas partículas (moléculas o átomos). En principio, las propiedades observables de un gas (presión, volumen, temperatura) son consecuencia del comportamiento de dichas partículas.
Ley de Boyle: Esta película muestra como cambia la presión de un gas con el volumen cuando la temperatura y número de moles son constantes.
Ley de Charles: Esta película muestra como cambia el volumen de un gas con la temperatura cuando la presión y número de moles son constantes.
Ley de Gay-Lussac: Esta película muestro como cambia la presión de un gas con la temperatura cuando el volumen y número de moles son constantes.
La Teoría Cinético Molecular de los gases inicia con cinco postulados que describen el comportamiento de una molécula gaseosa. Esto e Estos postulados están basados en simples hechos científicos, pero también involucran algunas simplificaciones.
Postulados
- Un gas consiste en un grupo de partículas pequeñas que viajan en un movimiento en línea recta y obedeciendo las leyes de Newton.
- Las moléculas de gas no ocupan volumen (es decir, que son puntos).
- Las colisiones entre moléculas son perfectamente elásticas (es decir, que no hay pérdida ni ganancia de energía).
- No hay fuerzas atractivas ni repulsivas entre moléculas.
- La energía cinética promedio de una moléculas es 3kT/2. (T es la tempcolieratura absoluta y k es la constante de Boltzmann).
Choques de moléculas.
Factores que afectan la velocidad de reacción
Teniendo en cuenta los planteamientos de la teoría de las colisiones, cualquier condición que afecte la ocurrencia de choques efectivos, afectará igualmente la velocidad de reacción. Experimentalmente se ha establecido que los principales factores determinantes de la velocidad de las reacciones químicas son: la naturaleza y concentración de los reactivos, la temperatura a la que ocurre la reacción y la presencia de catalizadores.
Naturaleza de los reactivos
La tendencia a reaccionar que muestran unas sustancias con otras se relaciona con la distribución y estructura tridimensional de los electrones periféricos, con la energía de los enlaces que unen los diferentes átomos y con la afinidad entre átomos, moléculas o iones presentes. Por ejemplo, las sustancias en formas moleculares reaccionan más lentamente que las iónicas.
Comparación de las reactividades de litio, sodio y potasio al reaccionar con agua.
Superficie de contacto
Mientras más puntos de contacto haya entre las sustancias reaccionantes, la reacción ocurrirá más rápido. Por ejemplo, un terrón de azúcar es atacado por bacterias y levaduras, más lentamente que si se hallara disuelto en una solución acuosa.

Comparación de la velocidad de reacción con agua de Alka Seltzer entera y dividida en cuatro partes.
Concentración de los reactivos
A partir de la ecuación de velocidad sabemos que la velocidad es proporcional a la concentración de las especies químicas. Esto se debe a que al aumentar la concentración de las sustancias reaccionantes, se aumenta la probabilidad de choque entre sus moléculas, y por tanto la cantidad de colisiones efectivas. Por ejemplo, una granalla de zinc reacciona más rápidamente con ácido clorhídrico 12 molar que con ácido clorhídrico 6 molar. Cuando reacciona con ácido nítrico 6 molar ocurre una reacción de simple desplazamiento, pero cuando reacciona con ácido nítrico 15 molar, la concentración es tan elevada que favorece una reacción de oxidación redox.

Comparación de la velocidad de reacción a diferentes concentraciones de ácido clorhídrico y ácido nítrico.
Cuando los reactivos son gases, un aumento en la presión del sistema, genera un aumento del número de moléculas por unidad de área, lo que se traduce en un aumento de la concentración que lleva a su vez a una aceleración del proceso.
La magnitud en la cual se aumenta la velocidad, con cada aumento de concentración depende de la reacción y se debe determinar empíricamente.
Temperatura
Con base en la teoría de colisiones, así como en la teoría cinético-molecular, se comprende fácilmente que un aumento en la temperatura del sistema en reacción lleve a un aumento proporcional en la velocidad de reacción. A mayor temperatura, mayor energía cinética poseerán las moléculas y por tanto más cerca estarán de alcanzar el valor crítico, Ea. Así mismo, a mayor energía cinética, la frecuencia de choques se verá también incrementada, y por tanto, la probabilidad de choques efectivos aumentará.

La Alka Seltzer reacciona más rápidamente con agua caliente luego con agua al tiempo y por último con agua fría.
La Alka Seltzer reacciona más rápidamente con agua caliente.
Catalizadores
Un catalizador es una sustancia que afecta la velocidad de una reacción, ya sea incrementándola o retardándola. Los catalizadores se caracterizan porque son necesarios en muy bajas concentraciones y porque no son consumidos o transformados al final de la reacción. En ocasiones un catalizador puede intervenir en la reacción formando compuestos intermedios, que sirven de puente para la formación de los productos, pero al finalizar la reacción, la sustancia catalizadora siempre queda libre e inalterada.
El proceso general de alteración de la velocidad a través del empleo de catalizadores, recibe el nombre de catálisis. Cuando una sustancia actúa acelerando la reacción general se denomina catalizador positivo, mientras que si la retarda se denomina catalizador negativo o inhibidor. Por ejemplo, el oxígeno se puede obtener en el laboratorio por descomposición térmica del clorato potásico (KClO3), a 500 °C. Sin embargo, si se adiciona una pequeña cantidad de dióxido de manganeso, MnO2, la reacción ocurre a 150 °C, según la ecuación:
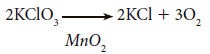
La acción de un catalizador se puede sintetizar como la disminución del valor crítico de energía, Ea, necesario para que la reacción ocurra. Los mecanismos para lograr esta disminución varían, desde la adsorción y por tanto, retención de los reactivos, hasta la formación de complejos activados entre reactivos y catalizadores.
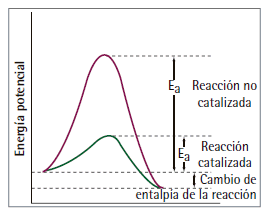
Disminución de la energía de activación
Catalizadores Biológicos
En los organismos vivos ocurren un sinnúmero de reacciones químicas, muchas de las cuales requerirían temperaturas o concentraciones demasiado altas para ser posibles. La manera como se logra que se lleven a término a temperatura ambiente y con concentraciones bajas es por medio de los llamados catalizadores biológicos o enzimas. Actualmente, la aplicación de la acción enzimática de múltiples sustancias orgánicas en la industria de alimentos, se halla muy desarrollada.
Modelo computacional de catálisis enzimática.
La es una enzima que puede realizar proteólisis. La quimotripsina consiste en una cadena polipeptídica de 245 residuos, con cinco enlaces disulfuro (-S-S-). Es una enzima digestiva encargada de degradar las proteínas de los alimentos en el intestino, Ver con los aminoácidos responsables de la actividad catalítica en colores.
Escojemos este ejemplo de la quimotripsina, porque aunque es de un nivel de profundidad superior teóricamente, ilustra como se pueden llevar a cabo las reacciones a nivel del organismo. Electrónicamente son muchos procesos los que se llevan a cabo, pero lo maravilloso en nuestro organismo, es que son muy rápidos y muy específicos.
Aunque una enzima llamada pepsina comienza a digerir las moléculas de proteína mientras están en el estómago, la mayor parte de la digestión de la proteína tiene lugar después de que la comida sale del estómago y pasa al intestino delgado. Aquí, enzimas como la tripsina, la quimotripsina, la elastasa, la carboxipeptidasa y la aminopeptidasa convierten las moléculas de proteína en aminoácidos, dipéptidos y tripéptidos. Los dipéptidos y tripéptidos son convertidos en aminoácidos por otras enzimas. Una vez que los aminoácidos están libres, pueden pasar al torrente sanguíneo y circular por todo nuestro cuerpo.
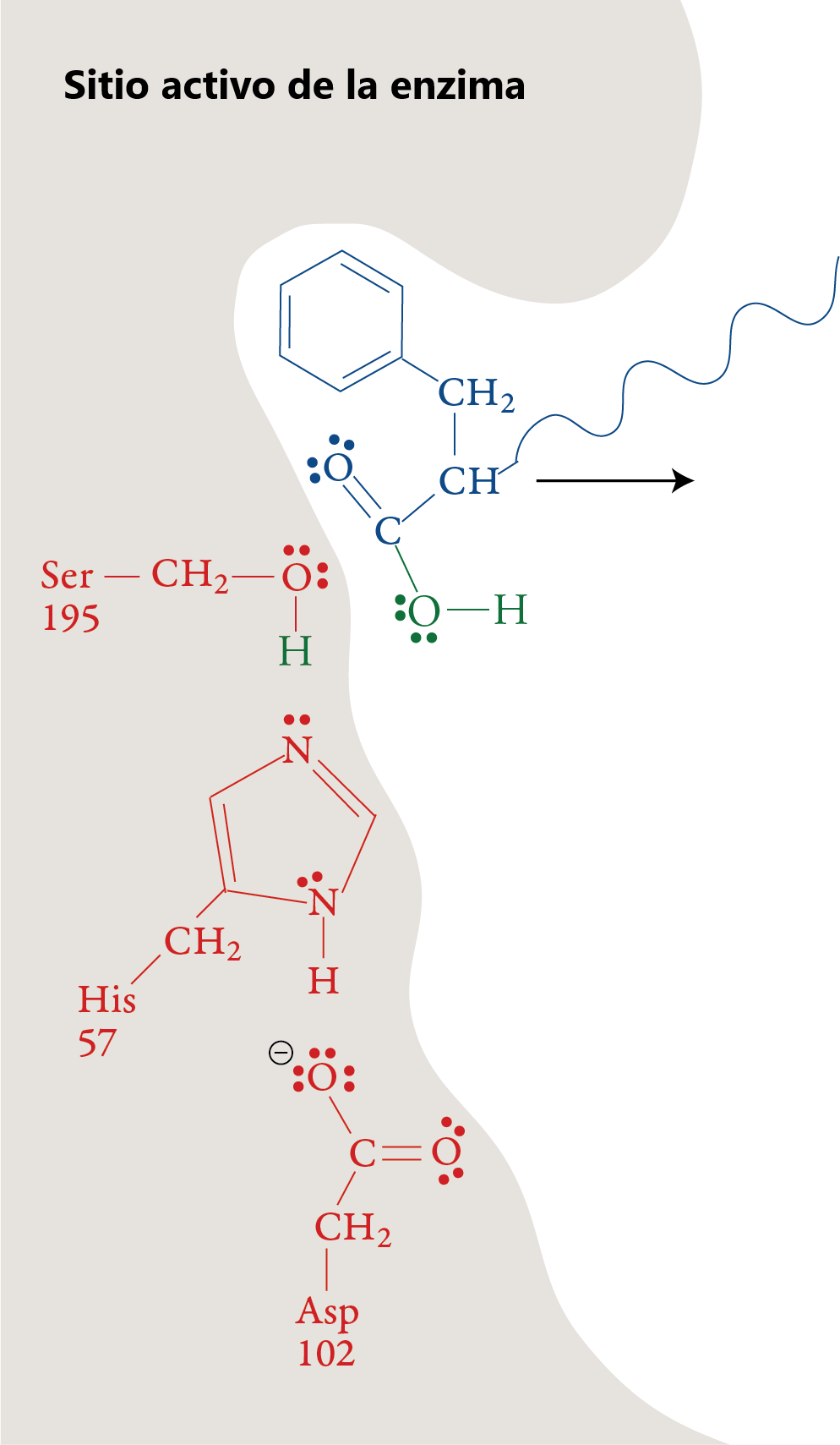
Los aminoácidos esenciales en el proceso de catálisis son la His 57 y Ser 195, estos aminoácidos se encuentran localizados en el sitio de fijación del sustrato, junto con el Asp 102. Estos tres aminoácidos se encuentran unidos por enlaces por puentes de hidrógeno, y se conocen con el nombre de tríada catalítica . Este agujero catalítico se encuentra en toda la familia de serina proteasas.
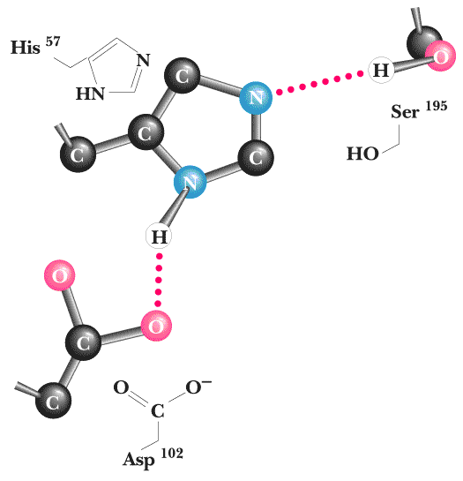
Catálisis en el sitio activo de la quimotripsina.
Etapa 1
Un sustrato polipeptídico se mueve hacia el sitio activo de la enzima. La forma, el tamaño y la secuencia de aminoácidos del sitio activo de la quimotripsina permiten que esa parte de la enzima se una a una porción de un polipéptido que tiene cadenas laterales no polares, como las que se encuentran en la fenilalanina. Una vez que el polipéptido está en el sitio activo, un ion H+ se mueve del aminoácido serina en la posición 195 (Ser-195) de la secuencia de aminoácidos de la enzima al aminoácido histidina en la posición 57 (His-57). El átomo de oxígeno en el grupo hidroxilo de la serina forma un enlace covalente con el carbono de uno de los enlaces peptídicos del sustrato, desplazando los dos electrones de uno de los enlaces dobles para formar un par solitario.
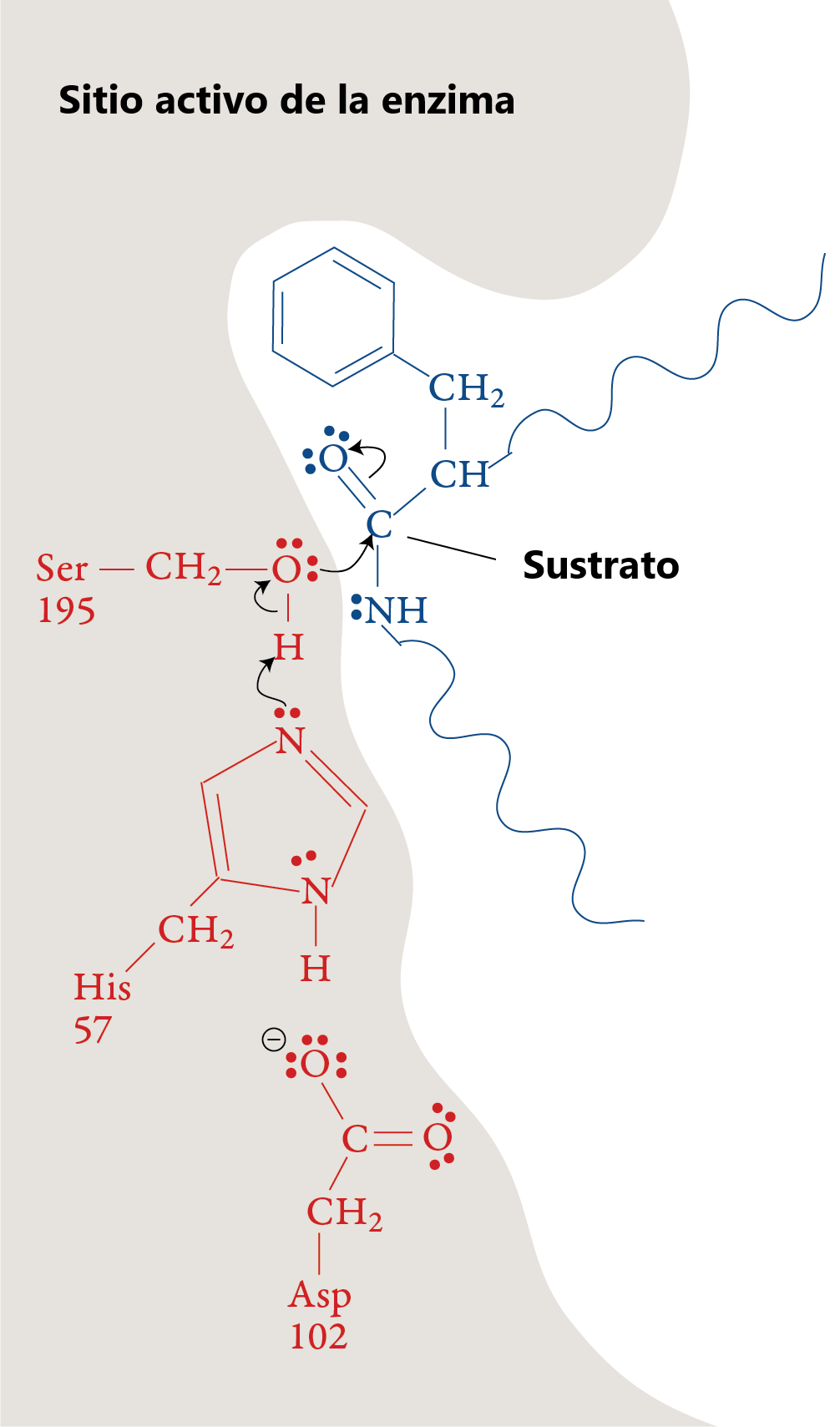
Etapa 2
La carga positiva formada en His-57 está estabilizada por la carga negativa en el ácido aspártico en la posición 102 (Asp-102). Cuando se reforma el doble enlace de carbono y oxígeno en el enlace peptídico, se rompe el enlace entre el carbono y el nitrógeno en el enlace peptídico. El grupo que contiene nitrógeno se estabiliza mediante la formación de un enlace con un átomo de hidrógeno de His-57.
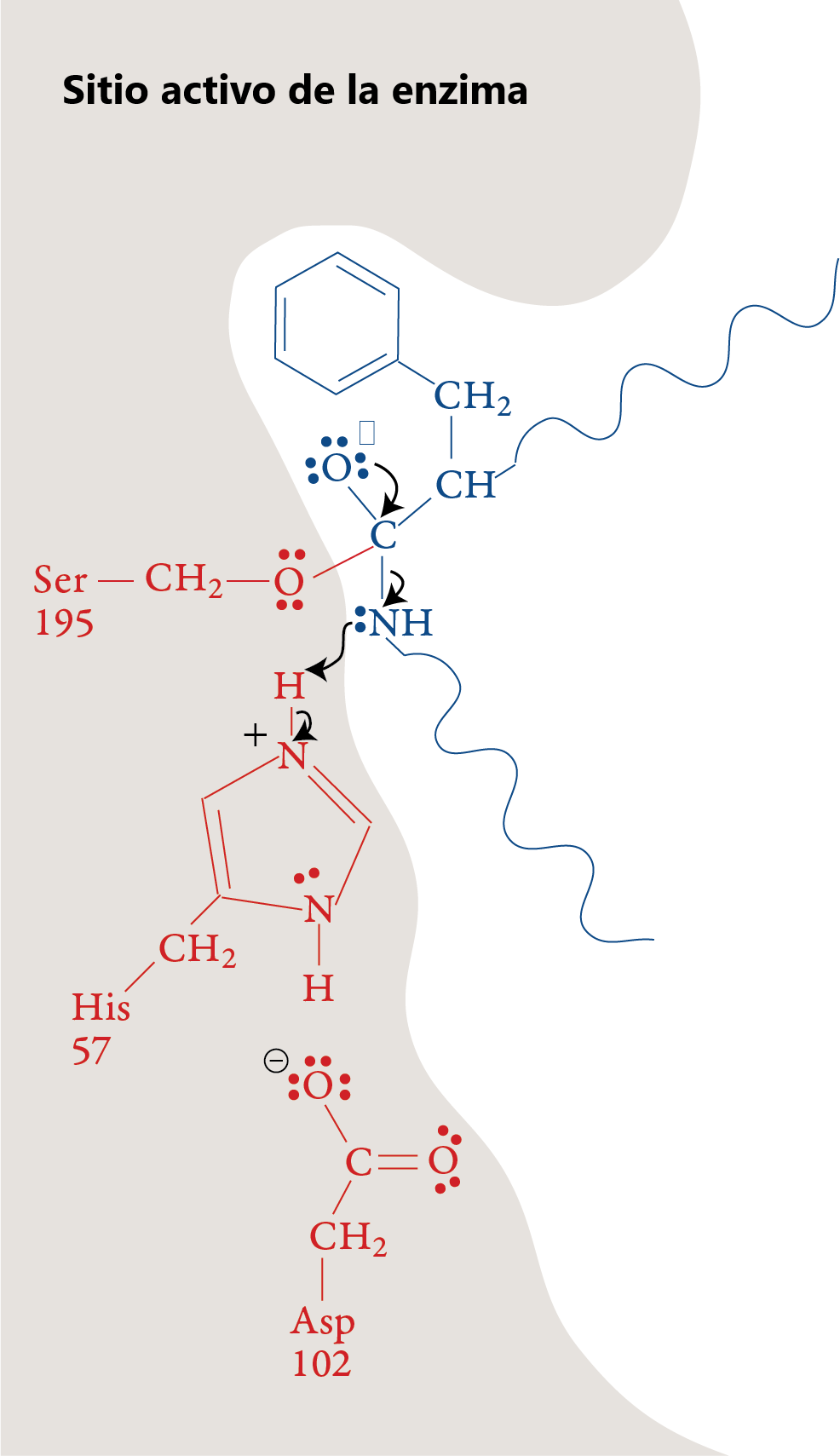
Etapa 3
La porción del polipéptido que contiene el átomo de nitrógeno del enlace peptídico roto sale del sitio activo.
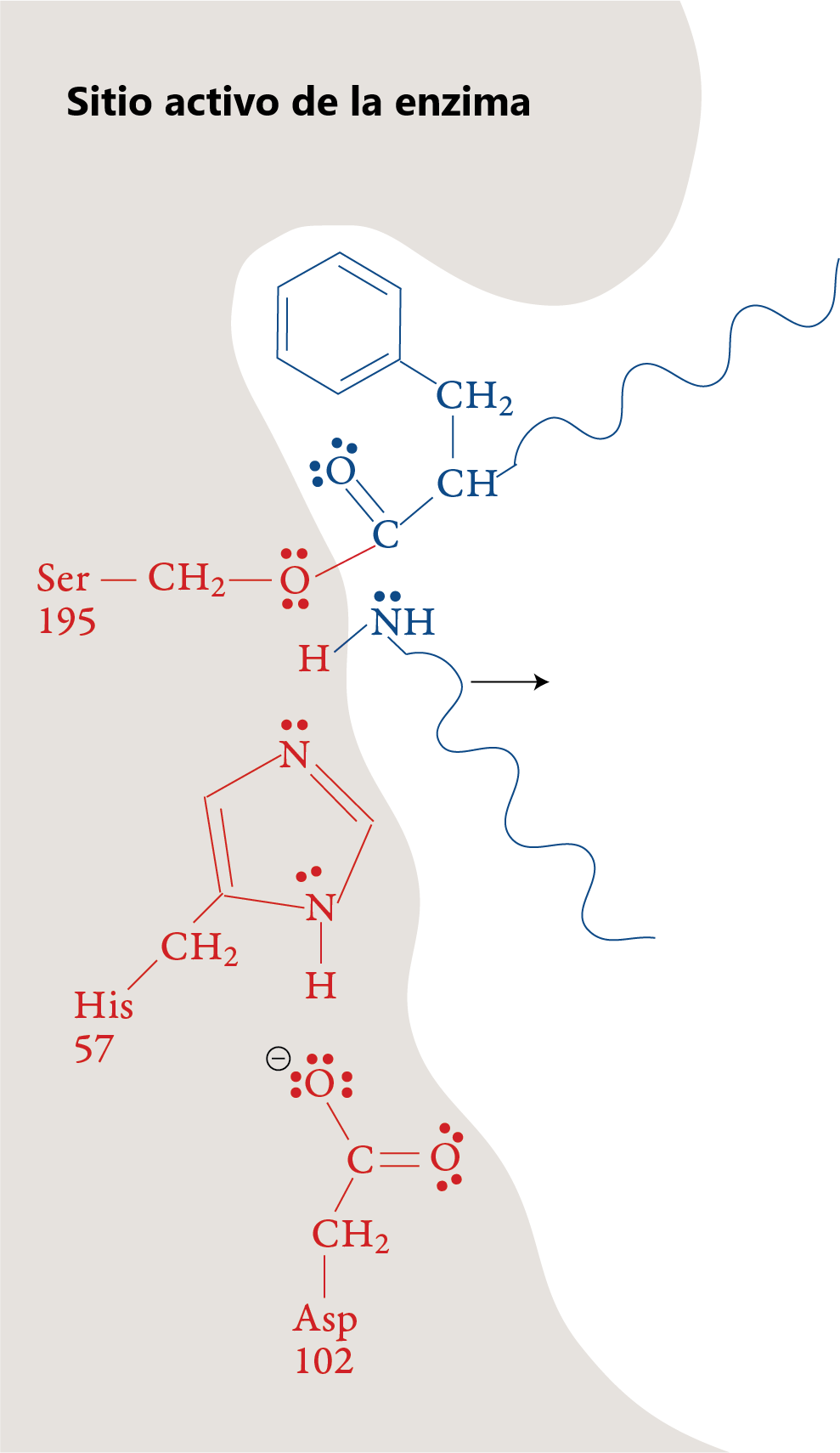
Etapa 4
Una molécula de agua se mueve hacia el sitio activo. El átomo de oxígeno en la molécula de agua pierde un ion H+ y lo transfiere a un átomo de nitrógeno en His-57. Esto permite que el átomo de oxígeno del agua forme un enlace con el átomo de carbono de la porción restante del sustrato. Como en la etapa 1, uno de los enlaces del doble enlace se desplaza hacia arriba para formar un par solitario.
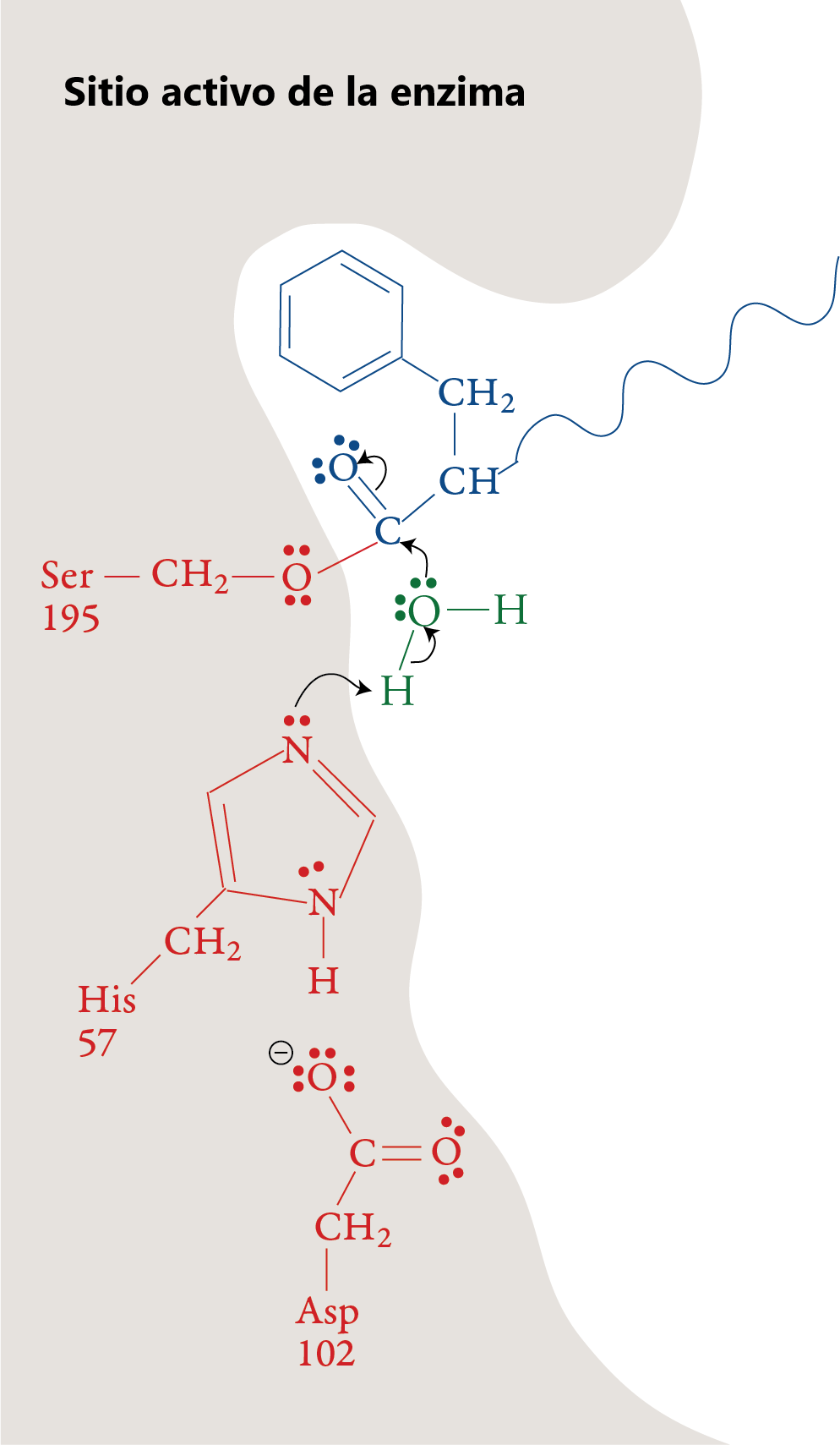
Etapa 5
Cuando se reforma el doble enlace, se rompe el enlace entre el carbono y el oxígeno de Ser-195. El grupo –OH en Ser-195 se restaura con una transferencia de un ion H+ de His-57. Con este paso, el Ser-195 y la His-57 vuelven a sus formas originales.
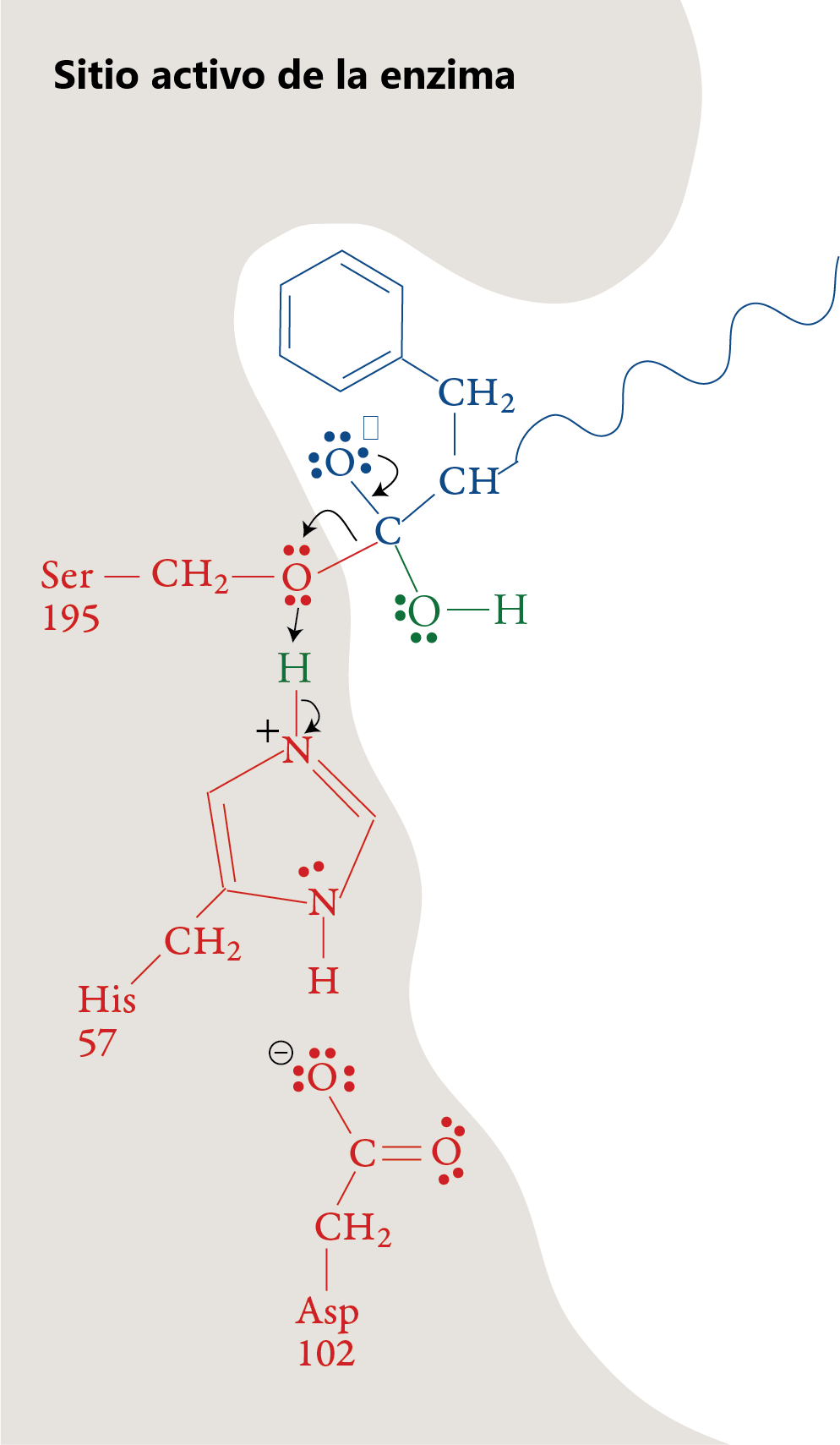
Etapa 6
La porción restante del sustrato sale del sitio activo, dejando el sitio activo en su forma original, listo para repetir las etapas 1-5 con otra molécula polipeptídica.