Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
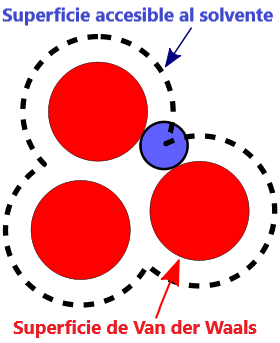
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Cargas parciales, para ver el valor de la carga relativa positiva o negativa de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Equilibrio Químico
De acuerdo a los cálculos, el carbono en la forma de cambiará espontáneamente a . Los dueños de diamantes parecen despreocupados por este hecho; ellos saben por experiencia que sus inversiones en gemas están seguras. En realidad la transformación de diamante a grafito, sí tiene lugar, pero tan lentamente, que no es detectable aún en varias vidas humanas. La velocidad de esta reacción es muy baja, por lo que esto es lo que hace la diferencia.
El elemento bario es muy venenoso cuando se ingiere como iones de bario (Ba+2) cuando el sulfato de bario (BaSO4) se disuelve y forman los iones Ba+2 y SO4-2. Sin embargo, suspensiones de BaSO4 sólido se ingieren de forma rutinaria por los pacientes sometidos a diagnóstico cuando se hacen radiografías del estómago e intestino. Los pacientes no son afectados porque realmente se disuelve una cantidad muy pequeña de BaSO4 en el cuerpo. Este equilibrio existente entre la forma sólida e iónica del BaSO4 está muy desplazada hacia la forma sólida por lo que no hay daño en el organismo.
Procesos espontáneos y no Espontáneos
Hace varios años, los turistas visitaban la "colina de la gravedad" en la ciudad de Salt Lake, en donde una ilusión óptica hacía aparecer una corriente de agua que fluía hacia la parte superior. la fascinación con la escena venía por la aparente violación de las leyes naturales. Los procesos que se llevan a cabo naturalmente sin causas aparentes o estímulos son llamados procesos espontáneos. Los procesos no espontáneos se llevan a cabo únicamente como resultado de una causa o estímulo. Por ejemplo, imagine que usted se encuentra en la posición indicada de la figura y quiere mover una piedra.

Colina de la Gravedad en la ciudad de Salt Lake, Estados Unidos
En A, la piedra rodará hacia abajo de la colina tan pronto que la suelte; el proceso inicia y se lleva a cabo espontáneamente. En B, usted debe empujar la piedra un poco, pero una vez iniciado, la piedra cae espontáneamente. La situación en C es, es muy diferente, usted debe empujar continuamente la piedra o no se moverá hacia arriba. El proceso es no espontáneo; se lleva a cabo solo por la aplicación de un estímulo externo.
| A. Proceso espontáneo | B. Proceso espontáneo una vez iniciado | C. Proceso no espontáneo |
|---|---|---|
A.  |
B.  |
C.  |
Conforme la piedra va rodando hacia abajo de la colina, libera energía, se mueve desde un estado de alta energía potencial a uno de menor energía. Conforme usted empuja la piedra hacia arriba de la colina, esta gana energía (de usted). Los procesos que liberan energía se denominan exergónicos (energía hacia afuera), mientras que los que ganan energía se denominados endergónicos (energía hacia adentro). Muy frecuentemente, los cambios de energía en las reacciones químicas involucran al calor. Esos cambios son denominados como exotérmico (calor hacia afuera) o endotérmico (calor hacia dentro).
La Muchos procesos espontáneos liberan energía. Un pedazo de madera, una vez encendido, se quema espontáneamente y libera energía como calor y luz. A temperatura ambiente normal, el vapor se condensa espontáneamente en agua y libera calor. Sin embargo, algunos procesos espontáneos están siempre acompañados por otro cambio llamado incremento de entropía. La entropía describe el desorden o aleatoriedad de un sistema. Así, un incremento acompaña a todos los procesos espontáneos en los cuales la energía permanece constante y es ganada. Una gota de tinta colocada en un vaso con agua eventualmente se distribuirá uniformemente en el agua, aunque no se agite el agua. No ocurre ningún cambio de energía con la difusión de la tinta, pero la distribución de tinta en el agua es un estado más desordenado (mayor entropía) que cuando toda la tinta estaba en una simple gota. el hielo funde espontáneamente a 20o y el proceso absorbe calor. El proceso se lleva a cabo porque la distribución al azar de las moléculas de generan un estado de mayor entropía que el estado molecular ordenado de las moléculas de agua encontradas en el hielo .