Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
- Superficie VDW, la superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.

Enlace Covalente
Molécula de H2CO3
Para escribir la estructura de Lewis del ácido carbónico (H2CO3), sigue estos pasos:
- Cuentar los electrones de valencia:
- Esqueleto de la molécula:
- Forma enlaces simples entre átomos:
- Distribuir los electrones restantes:
- Verificar la estructura:
• Carbono (C): 4 electrones de valencia.
• Oxígeno (O): 6 electrones de valencia por átomo. Como hay 3 átomos de oxígeno, hay un total de (6 x 3 = 18) electrones.
• Hidrógeno (H): 1 electrón de valencia por átomo. Como hay 2 átomos de hidrógeno, hay un total de (1 x 2 = 2) electrones.
Total: (4 + 18 + 2 = 24) electrones de valencia.
• El átomo de carbono es el átomo central porque puede formar más enlaces (4).
• Los oxígenos y los hidrógenos unidos a los oxígenos se disponen alrededor del carbono.
• Esquema básico:
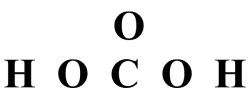
• Conectar los átomos según el esqueleto con enlaces simples, esto usa 2 electrones por enlace.
• Enlaces formados:
- C-O (dos enlaces)
- O-H (dos enlaces)
- C=O (un enlace doble).
• Asignar electrones a los átomos para completar sus octetos (o duetos en el caso del hidrógeno).
• Después de formar los enlaces simples y el doble enlace, distribuir los electrones restantes para completar los octetos de los oxígenos y el carbono.
• El carbono debe tener 8 electrones en total (4 enlaces).
• Cada oxígeno debe tener 8 electrones (incluyendo los enlaces y los pares no enlazantes).
• Los hidrógenos deben tener 2 electrones (un enlace).
• Los oxígenos están distribuidos con enlaces simples y dobles, con pares solitarios completando los octetos.
• La estructura de Lewis del ácido carbónico será:

Ion Bicarbonato, HCO3-
Pasos para dibujar la estructura de Lewis del bicarbonato (HCO3-):
- Contar los electrones de valencia:
- Escribir el esqueleto de la molécula:
- Distribuir los electrones:
- Completar octetos:
- Ajustar los electrones para la carga negativa:
- Verificar la estructura:
- Resultado final:
• Carbono (C): 4 electrones de valencia.
• Oxígeno (O): 6 electrones de valencia (hay 3 átomos de oxígeno).
• Hidrógeno (H): 1 electrón de valencia.
• Carga negativa (1-): Añadir 1 electrón.
• Total: (4 + (6 x 3) + 1 + 1 = 24) electrones de valencia.
• Colocar el carbono en el centro, ya que es el átomo menos electronegativo.
• Conectarlo a un átomo de hidrógeno y a dos átomos de oxígeno (debería quedar algo así: H - C - O - O).

• Comenzar colocando pares de electrones alrededor de los átomos de oxígeno para completar sus octetos. Cada oxígeno necesita 8 electrones.
• Asignar enlaces sencillos entre el carbono y los dos oxígenos.
• Después de distribuir los electrones, si un oxígeno no tiene un octeto completo, puede convertir un par de electrones de un enlace sencillo en un enlace doble con el carbono.
• En el bicarbonato, uno de los oxígenos tiene un enlace doble (C=O) y los otros tienen un enlace simple (C-O).
• Asegurarse de que la estructura refleje la carga -1, observe el oxígeno con halo rojo. Esto se puede hacer agregando un par de electrones al oxígeno que tiene el enlace simple, lo que le da una carga negativa.
• Asegurarse que todos los átomos tengan el número correcto de electrones de valencia (octeto para C y O, y dos para H).
• Confirmar que la carga total es -1.

• La estructura de Lewis del bicarbonato mostrará un carbono central con un enlace doble a un oxígeno, un enlace sencillo a otro oxígeno que tiene un par de electrones solitarios (carga negativa), y un enlace sencillo a un hidrógeno.
• El bicarbonato HCO3- con carga -1 se puede combinar con iones positivos, por ejemplo:

Ion Carbonato, CO3-2
Pasos para dibujar la estructura de Lewis del ion carbonato:- Contar los electrones de valencia:
- Escribir el esqueleto de la molécula:
- Distribuir los electrones:
- Completar los octetos:
- Verificar electrones restantes:
- Determinar la formalidad y la carga:
- Dibujar la estructura final:
- Representar la estructura final mostrando un doble enlace con un oxígeno y enlaces simples con los otros dos. Asegurarse de mostrar las cargas en los oxígenos que corresponden.
• Carbono (C): 4 electrones de valencia.
• Oxígeno (O): 6 electrones de valencia (hay 3 átomos de oxígeno).
• Carga del ion: 2 electrones adicionales (por ser CO3-2).
• Total: 4 + (3 × 6) + 2 = 26 electrones de valencia.
• Colocar el carbono en el centro y une los tres átomos de oxígeno a él. La disposición es típica en un ion trigonal planar.

• Comienza colocando un par de electrones (enlaces) entre el carbono y cada oxígeno. Esto utilizará 6 electrones (3 enlaces simples).
• Asignar los electrones restantes a los átomos de oxígeno para completar sus octetos. Coloca dos pares de electrones (4 electrones) en cada oxígeno. Después de esto, los electrones utilizados son 6 (enlaces) + 12 (pares en oxígenos) = 18 electrones.
• Quedarán 8 electrones. Asignar un doble enlace a uno de los átomos de oxígeno y ajustar los electrones para que todos los átomos de oxígeno tengan un octeto completo. Esto también hace que la carga total del ion sea correcta.
• Asegurarse que la carga formal de cada átomo esté correcta:
Oxígenos con enlaces simples: cada uno tendrá una carga formal de -1 lo que se distingue con halo color rojo.
El ion completo debe tener una carga total de -2.

El ion carbonato CO3-2 se puede combinar con iones positivos, por ejemplo;
