Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
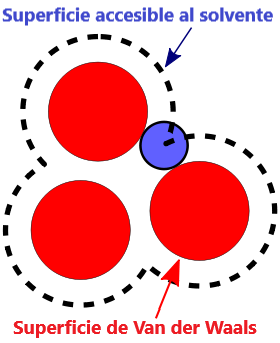
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Cargas parciales, para ver el valor de la carga relativa positiva o negativa de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Nomenclatura
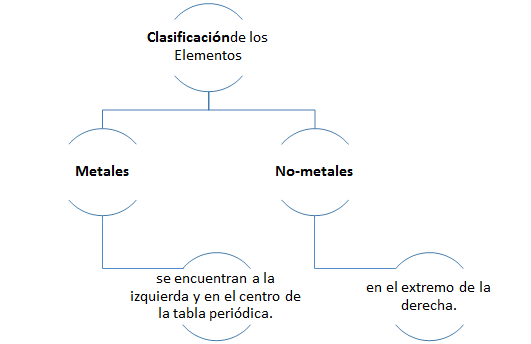
- Para efectos de nomenclatura y estudio de las propiedades químicas una clasificación muy importante de los elementos es en metálicos y no-metálicos.
- Se puede determinar aproximadamente si un elemento es metal o no-metal por su posición en la tabla periódica. Los metales se encuentran a la izquierda y en el centro de la tabla periódica y los no-metales en el extremo de la derecha.
- En la tabla 1 se da una distribución de los elementos en las dos categorías. Obsérvese la línea diagonal escalonada que divide aproximadamente la tabla en elementos metálicos y no-metálicos.
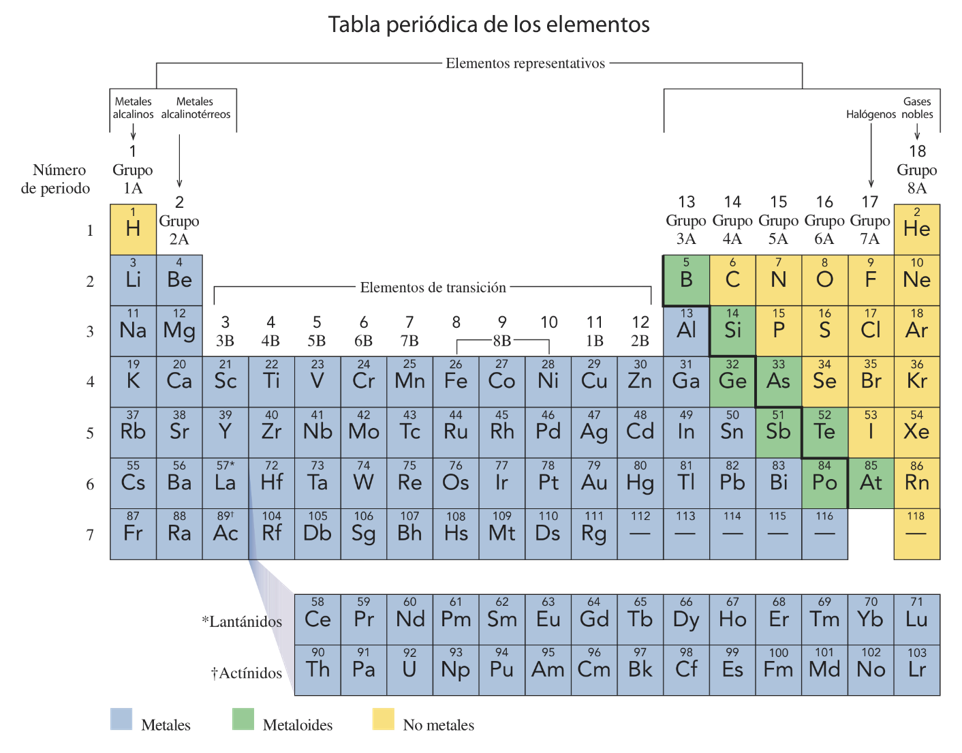
- Cuando se comparan dos elementos, el más metálico es el que se encuentra más hacia la izquierda o más hacia la parte inferior de la tabla periódica.
- Existen algunas reglas útiles basadas en el concepto del número de oxidación que permiten predecir las fórmulas de un gran número de compuestos.
- La porción más positiva se escribe de primero y se nombra de último. Este puede ser un metal, un ion poliatómico positivo, un hidrógeno, o simplemente la porción menos electronegativa del compuesto.
- La porción más negativa se escribe de último y se nombra primero. Este puede ser un anión o simplemente el átomo más electronegativo.
- Ejemplo: cloruro de sodio, yoduro de amonio y sulfato de potasio:
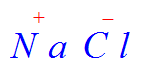
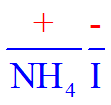
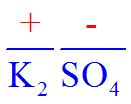
Guía de Estudio
Metales y No-Metales
Quiz: Metales y No-Metales
Instrucciones: Responda cada pregunta en 2-3 frases.
- ¿Dónde se encuentran generalmente los metales en la tabla periódica?
- ¿Dónde se encuentran generalmente los no-metales en la tabla periódica?
- ¿Qué línea en la tabla periódica ayuda a distinguir entre metales y no-metales?
- Cuando se comparan dos elementos, ¿cómo se determina cuál es más metálico basándose en su posición en la tabla periódica?
- ¿Qué concepto es útil para predecir las fórmulas de muchos compuestos?
- En una fórmula química, ¿qué porción se escribe primero?
- En una fórmula química, ¿qué porción se nombra de último?
- En una fórmula química, ¿qué porción se escribe de último?
- En una fórmula química, ¿qué porción se nombra primero?
- Mencione dos ejemplos de compuestos dados en el texto donde se aplica la regla de nomenclatura.
Clave de Respuestas del Quiz
- Generalmente se encuentran a la izquierda y en el centro de la tabla periódica.
- Generalmente se encuentran en el extremo de la derecha de la tabla periódica.
- La línea diagonal escalonada ayuda a distinguir aproximadamente entre metales y no-metales.
- El elemento más metálico es el que se encuentra más hacia la izquierda o más hacia la parte inferior de la tabla periódica.
- El concepto del número de oxidación es útil para predecir las fórmulas.
- La porción más positiva se escribe de primero.
- La porción más positiva se nombra de último.
- La porción más negativa se escribe de último.
- La porción más negativa se nombra primero.
- Cloruro de sodio, yoduro de amonio, sulfato de potasio (cualquiera de dos).
Preguntas Formato Ensayo
- Explique cómo la posición de un elemento en la tabla periódica se relaciona con su clasificación como metal o no-metal, utilizando ejemplos para ilustrar los principios generales.
- Describa la línea diagonal escalonada en la tabla periódica y su función en la distinción aproximada entre elementos metálicos y no-metálicos.
- Analice la importancia del número de oxidación en la predicción de fórmulas químicas y cómo se relaciona con la nomenclatura de compuestos binarios.
- Compare y contraste la ubicación y nomenclatura de la porción positiva y negativa en una fórmula química, utilizando ejemplos del texto.
- Discuta cómo los simuladores computacionales, como el descrito en el texto, pueden facilitar la comprensión de la estructura molecular y sus propiedades.
Glosario de Términos Clave
- Metales
- Elementos químicos que generalmente se encuentran a la izquierda y en el centro de la tabla periódica, con ciertas propiedades características como conductividad eléctrica y térmica.
- No-Metales
- Elementos químicos que generalmente se encuentran en el extremo de la derecha de la tabla periódica, con propiedades diferentes a las de los metales.
- Tabla Periódica
- Una disposición tabular de los elementos químicos, ordenados por su número atómico, configuración electrónica y propiedades químicas recurrentes.
- Nomenclatura
- Un sistema de nombres para las sustancias químicas, basado en reglas específicas para identificar la composición de un compuesto.
- Número de Oxidación
- Un concepto utilizado en química para predecir las fórmulas de los compuestos y ayudar en la nomenclatura, representando la carga hipotética de un átomo en un compuesto.
- Porción Más Positiva
- En un compuesto químico, la parte que es menos electronegativa o tiene una carga positiva. Se escribe primero en la fórmula y se nombra de último.
- Porción Más Negativa
- En un compuesto químico, la parte que es más electronegativa o tiene una carga negativa. Se escribe de último en la fórmula y se nombra primero.
- Simulador Computacional
- Herramientas de software que permiten visualizar y manipular modelos moleculares para estudiar sus propiedades y comportamiento.
- Jsmol
- Un visor de código abierto para estructuras químicas en 3D y 2D, utilizado en el simulador descrito en el texto.
- Superficie VDW (van der Waals)
- Un modelo que representa la superficie de una molécula basado en los radios de van der Waals de los átomos, indicando dónde podría interactuar con otras moléculas.
- PEM (Mapa de Potencial Electrostático)
- Una representación visual de la distribución de carga eléctrica alrededor de una molécula, indicando regiones electropositivas y electronegativas.
- Cargas Parciales
- La carga relativa positiva o negativa en cada átomo dentro de una molécula debido a la distribución desigual de electrones en los enlaces covalentes.
- Dipolo Molecular
- El momento dipolar resultante de toda la molécula, que refleja la polaridad general de la molécula debido a la suma vectorial de los dipolos de enlace.