Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
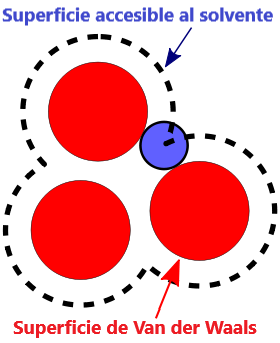
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Cargas parciales, para ver el valor de la carga relativa positiva o negativa de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Números de Oxidación
Existen algunas reglas útiles basadas en el concepto del número de oxidación que permiten predecir las fórmulas de un gran número de compuestos.
Una de las propiedades más importantes de los elementos es su estado de oxidación, o número de oxidación. El número de oxidación está determinado por las siguientes reglas:
- El número de oxidación de cualquier átomo sin combinar o elemento libre (por ejemplo, ) es cero.
- El número de oxidación para el oxígeno es – 2 (en los peróxidos es de – 1).
- El número de oxidación para el hidrógeno es +1 (en los hidruros es de – 1).
- Para iones simples, el número de oxidación es igual a la carga del ión. (Así, para Ba2+ el número de oxidación es + 2.)
- La suma de los números de oxidación para los átomos de los elementos en una fórmula determinada es igual a cero; en el caso de un ion poliatómico la suma es igual a la carga total. (Un ion poliatómico es una partícula cargada que contiene más de un átomo, por ejemplo, el ion .
- Existe una correlación definida entre los números de oxidación y los grupos en donde están localizados los elementos en la tabla periódica.
- Todos los elementos del grupo IA tienen un número de oxidación de +1, los elementos del grupo IIA tienen un número de oxidación de +2 y así sucesivamente.
- El número de oxidación negativo para cualquier elemento se puede obtener sustrayendo de 8 el número del grupo y dándole a la diferencia un signo negativo. De acuerdo con el equema anterior, el del flúor es – 1, el del azufre es – 2 y el del nitrógeno es – 3.
- Para predecir una fórmula química simplemente se unen los elementos con número de oxidación positivo a aquellos que tienen número de oxidación negativo, sin olvidar que la suma de todos los números en la fórmula final debe ser igual a cero.
- Infortunadamente, hay muchas excepciones a este sistema de asignar los números de oxidación a partir de la posición de los elementos en la tabla periódica. Muchos elementos (principalmente los de transición), tienen más de un número de oxidación, por lo tanto, estos números deberán memorizarse. En la siguiente tabla se dan algunos de estos elementos. Para facilitar el aprendizaje de la nomenclatura química es importante conocer los iones (positivos y negativos) más comunes junto con sus nombres y cargas.
Números de Oxidación de los Metales
| Elemento | Símbolo | Números de Oxidación Comunes |
|---|---|---|
| Litio | Li | +1 |
| Sodio | Na | +1 |
| Potasio | K | +1 |
| Rubidio | Rb | +1 |
| Cesio | Cs | +1 |
| Francio | Fr | +1 |
| Berilio | Be | +2 |
| Magnesio | Mg | +2 |
| Calcio | Ca | +2 |
| Estroncio | Sr | +2 |
| Bario | Ba | +2 |
| Radio | Ra | +2 |
| Escandio | Sc | +3 |
| Titanio | Ti | +2, +3, +4 |
| Vanadio | V | +2, +3, +4, +5 |
| Cromo | Cr | +2, +3, +6 |
| Manganeso | Mn | +2, +3, +4, +6, +7 |
| Hierro | Fe | +2, +3 |
| Cobalto | Co | +2, +3 |
| Níquel | Ni | +2, +3 |
| Cobre | Cu | +1, +2 |
| Zinc | Zn | +2 |
| Plata | Ag | +1 |
| Oro | Au | +1, +3 |
| Mercurio | Hg | +1, +2 |
| Aluminio | Al | +3 |
| Gallio | Ga | +3 |
| Indio | In | +3 |
| Estaño | Sn | +2, +4 |
| Plomo | Pb | +2, +4 |
| Bismuto | Bi | +3, +5 |
Tabla de Números de Oxidación de elementos en su estado natural y metales
| Categoría | Elementos | Número de Oxidación | Ejemplo de Sustancia |
|---|---|---|---|
| Estado Natural | H2, O2, N2 | 0 | H2 (Hidrógeno molecular) |
| Grupo I | Li, Na, K | +1 | NaCl (Cloruro de sodio) |
| Grupo II | Be, Mg, Ca | +2 | MgO (Óxido de magnesio) |
| Grupo III | B, Al, Ga | +3 | Al2O3 (Óxido de aluminio) |
Números de Oxidación Positivos y Negativos para No Metales
| Grupo | Elementos | Números de Oxidación Negativos | Números de Oxidación Positivos | Ejemplo de Sustancia |
|---|---|---|---|---|
| Grupo IV | C, Si | -4 | +2, +4 | CH4 (Metano), CO2 (Dióxido de carbono) |
| Grupo V | N, P | -3 | +3, +5 | NH3 (Amoniaco), HNO3 (Ácido nítrico) |
| Grupo VI | O, S, Se | -2 | +4, +6 | H2O (Agua), SO3 (Trióxido de azufre) |
| Grupo VII | F, Cl, Br, I | -1 | +1, +3, +5, +7 | HF (Ácido fluorhídrico), HClO4 (Ácido perclórico) |
En general, un número de oxidación positivo para cualquier elemento es igual al número del grupo del elemento en la tabla periódica. Por ejemplo el nitrógeno es + 5.
Metales con Múltiples Números de Oxidación y sus Cationes (Nombres Sistemáticos)
| Elemento | Símbolo | Iones | Nombres Sistemáticos |
|---|---|---|---|
| Cobre | Cu | Cu⁺, Cu²⁺ | Ión cobre(I), Ión cobre(II) |
| Cobalto | Co | Co²⁺, Co³⁺ | Ión cobalto(II), Ión cobalto(III) |
| Cromo | Cr | Cr²⁺, Cr³⁺ | Ión cromo(II), Ión cromo(III) |
| Hierro | Fe | Fe²⁺, Fe³⁺ | Ión hierro(II), Ión hierro(III) |
| Manganeso | Mn | Mn²⁺, Mn³⁺, Mn⁴⁺ | Ión manganeso(II), Ión manganeso(III), Ión manganeso(IV) |
| Mercurio | Hg | Hg₂²⁺, Hg²⁺ | Ión dimercurio(II), Ión mercurio(II) |
| Níquel | Ni | Ni²⁺, Ni³⁺ | Ión níquel(II), Ión níquel(III) |
| Oro | Au | Au⁺, Au³⁺ | Ión oro(I), Ión oro(III) |
| Plomo | Pb | Pb²⁺, Pb⁴⁺ | Ión plomo(II), Ión plomo(IV) |
| Estaño | Sn | Sn²⁺, Sn⁴⁺ | Ión estaño(II), Ión estaño(IV) |
Guía de Estudio
Números de Oxidación
Quiz
- ¿Cuál es el número de oxidación de un átomo sin combinar o elemento libre?
- ¿Cuál es el número de oxidación usual del oxígeno? ¿En qué caso es diferente?
- ¿Cuál es el número de oxidación usual del hidrógeno? ¿En qué caso es diferente?
- Para un ion simple, ¿a qué es igual el número de oxidación? Dé un ejemplo.
- En una fórmula química, ¿a qué es igual la suma de los números de oxidación de todos los átomos?
- En un ion poliatómico, ¿a qué es igual la suma de los números de oxidación de todos los átomos?
- Según las reglas generales, ¿cuál es el número de oxidación de los elementos del Grupo IA y IIA?
- Según las reglas generales, ¿cómo se obtiene el número de oxidación positivo de un elemento a partir de su grupo en la tabla periódica?
- Según las reglas generales, ¿cómo se obtiene el número de oxidación negativo de un elemento a partir de su grupo en la tabla periódica?
- ¿Por qué hay excepciones a las reglas generales para asignar números de oxidación basadas en la posición en la tabla periódica?
Clave de Respuestas del Quiz
- El número de oxidación de cualquier átomo sin combinar o elemento libre es cero.
- El número de oxidación usual del oxígeno es –2. En los peróxidos, su número de oxidación es –1.
- El número de oxidación usual del hidrógeno es +1. En los hidruros, su número de oxidación es –1.
- Para iones simples, el número de oxidación es igual a la carga del ion. Por ejemplo, para Ba2+ el número de oxidación es +2.
- La suma de los números de oxidación para los átomos de los elementos en una fórmula determinada es igual a cero.
- En el caso de un ion poliatómico, la suma de los números de oxidación es igual a la carga total del ion.
- Según las reglas generales, todos los elementos del grupo IA tienen un número de oxidación de +1, y los elementos del grupo IIA tienen un número de oxidación de +2.
- En general, un número de oxidación positivo para cualquier elemento es igual al número del grupo del elemento en la tabla periódica.
- El número de oxidación negativo para cualquier elemento se puede obtener restando de 8 el número del grupo y dándole a la diferencia un signo negativo.
- Hay muchas excepciones a este sistema, principalmente los elementos de transición, que tienen más de un número de oxidación y por lo tanto, sus números deben memorizarse.
Preguntas en Formato de Ensayo
- Explique la importancia del concepto de número de oxidación en la predicción de fórmulas químicas y la nomenclatura.
- Describa las reglas principales para asignar números de oxidación, destacando los casos especiales para el oxígeno y el hidrógeno.
- Compare cómo se determina la suma de los números de oxidación en una molécula neutra versus en un ion poliatómico, proporcionando ejemplos hipotéticos para ilustrar la diferencia.
- Analice la correlación entre la posición de un elemento en la tabla periódica y sus números de oxidación, discutiendo las reglas generales y por qué existen excepciones.
- Explique cómo se utiliza el concepto de números de oxidación positivo y negativo para predecir la fórmula química de un compuesto binario simple.
Glosario de Términos Clave
- Número de Oxidación (Estado de Oxidación):
- Una propiedad importante de los elementos que, siguiendo ciertas reglas, permite predecir las fórmulas de compuestos y entender la nomenclatura.
- Elemento Libre (Átomo sin combinar):
- Un átomo o elemento que no está combinado químicamente con otros átomos (ej. O2). Su número de oxidación es cero.
- Peróxidos:
- Compuestos que contienen el grupo peróxido (-O-O-), donde el número de oxidación del oxígeno es -1.
- Hidruros:
- Compuestos binarios de hidrógeno con un metal (generalmente metales del Grupo IA o IIA), donde el número de oxidación del hidrógeno es -1.
- Ion Simple:
- Una partícula cargada que contiene un solo átomo (ej. Ba2+). Su número de oxidación es igual a su carga.
- Ion Poliatómico:
- Una partícula cargada que contiene más de un átomo (ej. SO42-). La suma de los números de oxidación de sus átomos es igual a la carga total del ion.
- Grupo IA:
- La primera columna de la tabla periódica (metales alcalinos). Según las reglas generales, tienen un número de oxidación de +1.
- Grupo IIA:
- La segunda columna de la tabla periódica (metales alcalinotérreos). Según las reglas generales, tienen un número de oxidación de +2.
- Elementos de Transición:
- Los elementos localizados en los bloques d y f de la tabla periódica. A menudo presentan múltiples números de oxidación.
- Nomenclatura Química:
- El sistema de reglas para nombrar compuestos químicos. El concepto de número de oxidación es fundamental para muchos sistemas de nomenclatura.