Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
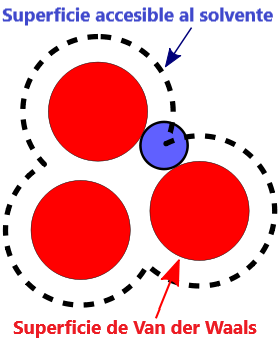
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Cargas parciales, para ver el valor de la carga relativa positiva o negativa de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Reacciones
Comencemos comparando dos procesos familiares: la ebullición del y la quema de una vela. Ambos procesos requieren una temperatura alta y, en ambos casos, la La sustancia original (agua o cera de velas) desaparece. Sin embargo, si miramos más de cerca, vemos una diferencia fundamental entre los dos.

Cuando hervimos agua, convertimos agua líquida en agua gaseosa. Ambas, agua y vapor, tienen la misma fórmula H2O, así que al hervir agua esto no afecta los enlaces químicos entre los átomos que constituyen la molécula de agua. Por otro lado, al calenter una vela, esto sí cambia la cera de la candela original en algo diferente. La cera de la candela es una mezcla de compuestos llamados parafinas, los cuales están constituídos de los elementos carbono e hidrógeno (un ejemplo típico es el -C20H42-). Cuando la cera hierve, forma dos compuestos nuevos, dióxido de carbono y agua. Las parafinas iniciales ya no están presentes.

Hervir y quemar son ejemplos de los dos tipos de cambios que observamos en la Tierra. Procesos que no alteran las fórmulas químicas de los materiales de partida, como la ebullición del agua, se denominan cambios físicos. Por el contrario, la quema de una vela es un cambio químico, en el que las fórmulas químicas de las materias primas y productos finales son diferentes. En un cambio químico, más comúnmente denominado como una reacción química, los átomos cambian la forma como están enlazados con los demás.
Los cambios físicos y químicos también se diferencian en que los cambios físicos pueden ser reversibles, en tanto que la mayoría de los cambios químicos no son reversibles. Por ejemplo, la ebullición del agua es reversible pero no podemos transformar de vuelta el dióxido de carbono y el agua en cera.
Como hemos visto, podemos describir la materia de diversas formas. las propiedades como el color, la masa, la densidad, el punto de ebullición y la solubilidad se denominan propiedades físicas. Una propiedad física es cualquier atributo de una sustancia que se puede medir o describir sin cambiar la fórmula química de la sustancia. Por otro lado, algunas propiedades, llamadas propiedades químicas, implican una reacción química. Por ejemplo, la capacidad de combustión de la gasolina es una propiedad química, porque debemos llevar a cabo una reacción química para observarla. El valor nutricional de una sustancia como la proteína o la es también una propiedad química, porque es la capacidad de la sustancia para producir una reacción química lo que las hace valiosas para nuestro organismo.