Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Cargas parciales, para ver el valor de la carga relativa positiva o negativa de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Reacciones
En una reacción química , a las sustancias iniciales se les llama reactivos, y a las sustancias que se originan se les llama productos. Durante una reacción química, los átomos, moléculas o iones interaccionan y se reordenan entre sí para formar los productos. Durante este proceso se rompen enlaces químicos y se forman nuevos enlaces. Los reactivos y los productos pueden estar en estado sólido, líquido o gaseosos, o pueden estar en solución.
Una ecuación química es una expresión taquigráfica de un cambio o reacción de naturaleza química. Muestra, entre otras cosas, el rearreglo de los átomos que están implicados. Una ecuación verbal enuncia con palabras en forma de ecuación, las sustancias que participan en una reacción. Por ejemplo, veamos el cambio que ocurre cuando el calcio y el azufre se combinan entre sí para formar un compuesto. El calcio, como la mayoría de los metales, es un sólido brillante de color plateado y el azufre es un sólido amarillo brillante quebradizo. Si mezclamos estos dos elementos y calentamos la mezcla suavemente, los elementos se convierten en un polvo blanco que tiene la fórmula química CaS. La ecuación química que corresponde a esta reacción es:
Ca + S → CaS

Cada símbolo representa un solo átomo de ese elemento, por lo que la ecuación química muestra lo que le sucede a cada átomo.
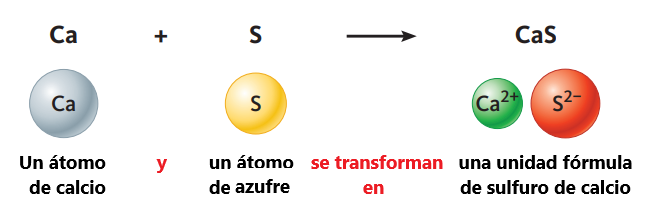
Tenga en cuenta que aunque las cargas de los átomos cambian, el número de cada tipo de el átomo no lo hace. Comenzamos con un átomo de calcio y un átomo de azufre, y terminamos con un átomo de calcio y un átomo de azufre.
Normalmente, cuando se lleva a cabo una reacción química, esta va acompañada de algún indicio visual, como un cambio permanente de color, formación de un sólido insoluble (precipitado), desprendimiento de un gas o cambio de temperatura, que se determina por la abosorción de calor y, a veces con la formación de una llama. Frecuentemente, los cambios químicos van acompañados de más de una de las manifestaciones indicadas; pero también puede suceder que se haya producido una reacción si haberse podido detectar ninguno de los cambios indicados, como es el caso de las reacciones en las que se produce un cambio de energía tan pequeño que no es posible detectarlo por nuestros sentidos.
En muchos casos, en los que no se puede percibir ningún cambio, es necesario hacer comprobaciones adicionales, que exigen aparatos de gran precisión para poder demostrar que se ha producido una reacción química.
Manifestaciones de una reacción química
Un cambio químico se lleva a cabo cuando:
- Se produce un gas.
- Se produce un sólido insoluble.
- Se observa un cambio de color permanentemente.
- Se observa producción o absorción de calor:
- Exotérmico – se libera calor.
- Endotérmico – se absorbe calor.