Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
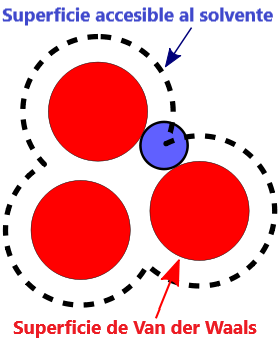
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Cargas parciales, para ver el valor de la carga relativa positiva o negativa de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Reacciones
Una ecuación química usa los símbolos y fórmulas de los reactivos y productos, y otros términos simbólicos para representar una reacción química. Las ecuaciones se escriben siguiendo los siguientes pasos:
- Los reactivos se separan de los productos con una flecha
(
 ) que
indica el sentido de la reacción. Una flecha doble
(
) que
indica el sentido de la reacción. Una flecha doble
( )
indica que la reacción se efectúa en ambas direcciones y establece un equilibrio entre los reactivos y
los productos.
)
indica que la reacción se efectúa en ambas direcciones y establece un equilibrio entre los reactivos y
los productos. - Los reactivos se colocan a la izquierda y los productos a la derecha de la flecha. Un signo (+) se coloca entre cada reactivo y entre cada producto, cuando es necesario.
- Las condiciones necesarias para efectuar la reacción pueden, si se desea, colocarse arriba o
abajo de la flecha o signo de igualdad. Por ejemplo, una letra delta mayúscula
(
 )
colocada sobre la flecha (
)
colocada sobre la flecha ( ) indica que se suministra calor a la reacción.
) indica que se suministra calor a la reacción. - Se colocan coeficientes (números enteros) frente a los símbolos de las sustancias (por ejemplo, 2 H2O) para equilibrar o balancear la ecuación e indicar el número de unidades fórmula (átomos, moléculas, moles, iones) de cada sustancia que reacciona o que se produce. Cuando no se indica número alguno, se sobrentiende que se trata de una unidad fórmula.
- El estado físico de la sustancias se indica mediante los siguientes símbolos: (s) para el estado sólido; (l) para el estado líquido; (g) para el estado gaseoso; y (ac) para las sustancias en solución acuosa.
- Empiece con las partes más complejas, es decir con los compuestos que tienen varios elementos. En algunos casos, simplemente consiste en ajustar primero los átomos diferentes al hidrógeno y al oxígeno.
- Ajuste el hidrógeno y el oxígeno agregando agua si es necesario, después de que todos los otros elementos estén balanceados.
- Deje los elementos en estado libre hasta el último momento, ya que cambiando los coeficientes de estos sólo cambian esta clase de átomos. Por ejemplo, cuando se escribe un 2 delante del H2O, se duplica el número de átomos de hidrógeno y oxígeno, pero cuando se escribe un 2 delante del Al sólo cambia el número de átomos de Al.
- Para reacciones con iones poliatómicos, ajuste el ion como grupo. Por ejemplo, el se ajusta como ion sulfato y no como átomos de S y átomos de O.
- Generalmente, si aparecen fracciones en la ecuación, se multiplica todo por el número más pequeño que elimine esta fracción. No es esencial hacer desaparecer las fracciones, sin embargo, es más simple en la mayoría de los casos. Además asegúrese al final, que todos los coeficientes estén en relación o proporción más baja posible; si no es el caso, simplifique.
Considere el siguiente ejemplo:

¡Atención!
Recuerde que es conveniente empezar por la sustancia más compleja.Empezando por el fosfato de magnesio (la parte más compleja) y considerando el fosfato de magnesio como grupo, escribimos un 2 delante del H3PO4 para ajustar el grupo fosfato y un 3 delante de Mg(OH)2 para ajustar el Mg dando como resultado:

Únicamente nos queda el hidrógeno y el oxígeno. Observando el hidrógeno, hay 12 átomos en la izquierda y por tanto necesitamos escribir un 6 delante del H2O. De igual forma se ajustan también los átomos de O que son en total 14. Esto da finalmente:

Al revisar todos los átomos de Mg, O, H, y P están en el mismo número en cada lado de la ecuación.