Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
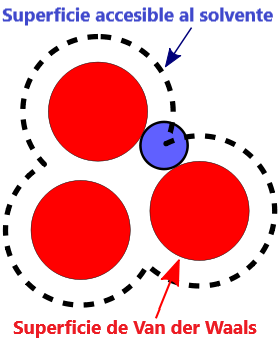
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Cargas parciales, para ver el valor de la carga relativa positiva o negativa de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Reacciones
En una reacción de descomposición, una sola sustancia se descompone o se rompe, produciendo dos o más sustancias distintas. A este tipo de reacciones se le puede considerar como el inverso de las reacciones de combinación. El material inicial debe ser un compuesto y los productos pueden ser elementos o compuestos. Generalmente se necesita calor para que ocurra la reacción. La forma general de estas ecuaciones es la siguiente:
AB → A + B
En general, para algunos tipos de compuestos estas reacciones son más específicas. Consideremos unas pocas entre las más comunes.
Hidratos
Cuando se calientan los hidratos se descomponen para dar lugar a agua y sal anhidra. Un hidrato es una sal que contiene una o más moléculas de agua por cada unidad fórmula y posee estructura de cristal. Cuando estas sustancias se calienta, se desprende agua; por ejemplo el sulfato de cobre pentahidratado se descompone de acuerdo a la siguiente ecuación:
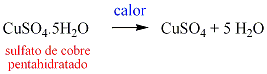
Cloratos
Cuando se calientan los cloratos () , se descomponen dando cloruros más oxígeno. Por ejemplo, el clorato de potasio se descompone de acuerdo a la siguiente ecuación:
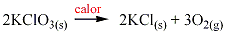
Óxidos de matales
Algunos pocos se descomponen al calentarlos dando lugar al metal libre y oxígeno. Por ejemplo el óxido mercúrico se descompone de acuerdo a la siguiente ecuación:
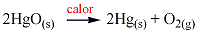
Carbonatos
La mayoría de carbonatos () se descomponen al calentarlos dando óxidos y CO2. Por ejemplo carbonato cálcico (piedra caliza) cuando se calienta forma óxido de calcio (cal viva) y CO2 de acuerdo a la siguiente ecuación:
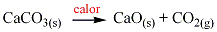
Los carbonatos del grupo IA no se descomponen fácilmente.
Bicarbonatos
Los bicarbonatos () en su mayoría cuando se calientan se descomponen para formar un ácido más agua y CO2. Por ejemplo, el bicarbonato de calcio se descompone de acuerdo a la siguiente ecuación:
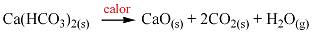
Cuando los bicarbonatos de los metales del Grupo IA se calientan, forman un carbonato más agua y dióxido de carbono (recuerde que los carbonatos de los metales IA son estables al calor mientras que otros carbonatos no lo son). Por ejemplo el bicarbonato de sodio se descompone de acuerdo a la siguiente ecuación:
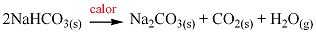
Agua
El agua puede descomponerse en hidrógeno y gas oxígeno por medio de una corriente eléctrica directa, de acuerdo a la siguiente ecuación:
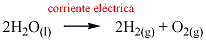
La electrólisis del agua se puede llevar a cabo en el laboratorio utilizando el siguiente procedimiento en el que se hace circular una corriente eléctrica continua de 12 voltios de una batería de moto, pero también se puede utilizar una pila de 9 voltios. Las conexiones se realizan con alambre de cobre.
Las reacciones químicas pueden ser endotérmicas (absorben energía de los alrededores) o exotérmicas (liberan energía a los alrededores). Lo anterior se puede explicar a nivel de los enlaces que se rompen y los nuevos enlaces que se forman. En este caso particular, la energía liberada por la formación de los nuevos enlaces H-H y O=O, es inferior a la energía requerida para romper las uniones H-O. La energía eléctrica de la pila, suple esta diferencia y por lo tanto, la reacción se lleva a cabo solamente cuando el sistema esta conectado a una batería o pila eléctrica.
Pasos para llevar a cabo el experimento:
Poner aproximadamente 3/4 partes de agua salada (la sal favorece la conducción de corriente eléctrica) en un frasco pequeño de boca ancha.
Abrir dos agujeros al tapón del frasco de vidrio por donde puedan pasar los tubos ensayo.
Llenar los tubos de ensayo con la solución.
Sacarle punta en ambos lados a dos lápices que se utilizarán como electrodos. Quitarles la goma y la parte de metal.
Conectar los alambres a la pila y en el otro extremo a la punta del lápiz.
Sin que se vacíen los tubos, colocarlos boca abajo dentro del frasco de vidrio.
Hacer la conexión de los electrodos a la batería.