Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
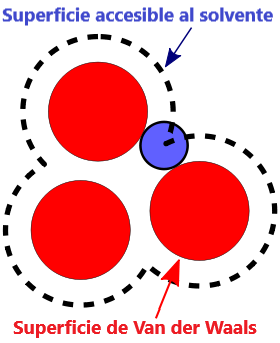
- Superficie VDW, la superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Alcanos

Escuchar Podcast
Haz clic en el botón para cargar y reproducir el audio.
Descripción y Estructura
Los cicloalcanos son alcanos que contienen un anillo de tres o más átomos de carbono. Se encuentran frecuentemente en química orgánica y se caracterizan por la fórmula molecular (CnH2n).
Conformaciones y Estabilidad
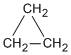
El ciclopropano, que sólo contiene tres átomos de carbono, debe tener la forma de un triángulo equilátero y por tanto con ángulos de enlace carbono-carbono de 60º.
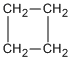
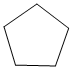
El ciclobutano, que geométricamente es un cuadrado, debe tener ángulos de enlace que tiende a 90º. En el ciclopentano se sabe que los ángulos de enlace carbono-carbono tienden a 108º y en el ciclohexano a 109º.
Adolf von Baeyer propuso, en 1885, que los cicloalcanos cuyo ángulo de enlace difería del ángulo de enlace ideal de 109º, deberían estar tensionados y, por tanto, serían más inestables que aquellos cicloalcanos cuyos ángulos de enlace fuesen iguales o muy próximos a 109º. De acuerdo con esta teoría, el ciclopropano tendría una tensión angular que se podría cuantificar como la diferencia entre el ángulo tetraédrico de 109º y su ángulo de enlace carbono-carbono, que es de 60º.
Tensión angular del ciclopropano 109º - 60º = 49º
De la misma forma se pueden calcular las tensiones angulares del ciclobutano, ciclopentano y ciclohexano:
Tensión angular del ciclobutano 109º - 90º = 19º
Tensión angular del ciclopentano 109º - 108º = 1º
Tensión angular del ciclohexano 109º - 109º = 0º
Conformaciones del ciclohexano.
El ciclohexano es un hidrocarburo cíclico que no presenta tensión angular ni tampoco tensión torsional. La falta de tensión angular es fácil de explicar porque los ángulos de enlace carbono-carbono son de 109º. Sin embargo, si el ciclohexano fuese plano debería presentar una importante tensión torsional debido al eclipsamiento de sus doce enlaces C-H. En realidad, adquiere una conformación doblada, denominada conformación de , en la que no existe ningún tipo de eclipsamiento H-H y por tanto no hay tensión torsional porque todos los enlaces C-H están alternados. En la siguiente figura se indica la conformación de silla del ciclohexano, junto con una representación de Newman a lo largo de los enlaces C1-C2 y C4-C5, y en la que se aprecia la posición alternada de los enlaces C-H.
La segunda conformación del ciclohexano, mucho menos estable, es el . En esta conformación, los ángulos son próximos a la disposición tetraédrica y la tensión angular es mínima. Sin embargo, el bote está desestabilizado por la repulsión entre los hidrógenos que se sitúan hacia el interior del bote.
¡Atención!
para obser las conformaciones de silla y bote en el ciclohexano.Conformaciones de silla y bote del ciclohexano
Representación de la estructura en dos dimensiones.
Como se puede ver, los cicloalcanos se nombran, bajo el sistema de la IUPAC, añadiendo el prefijo ciclo- al nombre del alcano sin ramificar con el mismo número de carbonos que el anillo. Los grupos sustituyentes se identifican del modo usual. Sus posiciones se especifican numerando los átomos de carbono del anillo en el sentido que dé el localizador más bajo al sustituyente en el primer punto de diferencia.
Las reglas para denominar a los cicloalcanos sustituidos son similares a las que se aplican a los alcanos de cadena abierta. Para la mayor parte de los compuestos sólo hay dos:
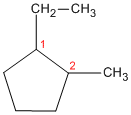
- Determinar la sustancia principal. Se cuenta la cantidad de átomos de carbono en el anillo y en la cadena sustituyente más larga. Si la primera es igual o mayor que la segunda, el nombre del compuesto es de un cicloalcano sustituido con alquilos. Si ocurre a la inversa (la cantidad de átomos de carbono en el sustituyente mayor es mayor que en el anillo), el nombre del compuesto es el de un alcano sustituido con cicloalquilo. Por ejemplo: metilciclopentano, 1-ciclopropilbutano.
- Numerar los sustituyentes. Para numerar los cicloalcanos sustituidos con grupos alquilo, se
toma un punto de fijación como C1 y su numeran los sustituyentes en el anillo de tal manera que el
segundo sustituyente tenga el número más bajo posible. Si continúa la ambigüedad, se numera de tal
modo que el tercero o cuarto sustituyente tenga el número más bajo posible, hasta encontrar un
punto de diferencia. Ejemplo: 1,3-dimetilciclohexano y no 1,5-dimetilciclohexano.
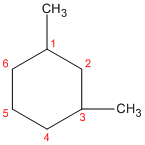
Cuando hay dos o más grupos alquilo distintos que pueden recibir los mismos números, se numeran por orden alfabético, el grupo que precede alfabéticamente tendrá la numeración más baja. Ejemplo: 1-etil-2-metilciclopentano y no 2-etil-1-metilciclopentano.
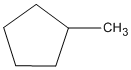
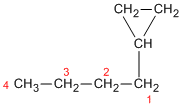
Guía de Estudio
📚 Guía Interactiva de Cicloalcanos 📚
Haz clic en cualquier pregunta o término para revelar la respuesta o definición. Al abrir un elemento, los demás se cerrarán automáticamente dentro de su respectiva sección.
✨ Repaso de Cicloalcanos
Conceptos Fundamentales
Conceptos Fundamentales
Los Cicloalcanos son alcanos que contienen un anillo de tres o más átomos de carbono, a diferencia de los alcanos de cadena abierta.
La fórmula molecular general para los cicloalcanos es CnH2n.
Adolf von Baeyer propuso que los cicloalcanos cuyos ángulos de enlace diferían del ángulo ideal de 109° tendrían tensión angular y serían más inestables.
El ciclopropano se considera más inestable porque su ángulo de enlace de 60° se desvía significativamente del ángulo ideal de 109°, resultando en una mayor tensión angular.
La tensión angular es la diferencia entre el ángulo de enlace real de un cicloalcano y el ángulo de enlace tetraédrico ideal de 109°.
En su conformación de silla, el ciclohexano no presenta tensión torsional porque todos los enlaces C-H están alternados, evitando el eclipsamiento.
La conformación de bote del ciclohexano es una conformación doblada. Es menos estable que la silla debido a la repulsión entre los hidrógenos que se sitúan hacia el interior del bote.
Según las reglas de la IUPAC, un cicloalcano simple sin sustituyentes se nombra añadiendo el prefijo ciclo- al nombre del alcano sin ramificar con el mismo número de carbonos que el anillo.
Cuando un cicloalcano tiene sustituyentes alquilo, se compara la cantidad de átomos de carbono en el anillo y en la cadena sustituyente más larga. Si el anillo tiene igual o más carbonos, es un cicloalcano sustituido; si el sustituyente tiene más, es un alcano sustituido con cicloalquilo.
Si un cicloalcano tiene múltiples sustituyentes, se toma un punto de fijación como C1 y se numera el anillo para dar los localizadores más bajos posibles a los sustituyentes, resolviendo la ambigüedad por orden alfabético si es necesario.
❓ Quiz de Preguntas Cortas
Instrucciones: Responde cada pregunta en 2-3 frases.
✍️ Preguntas en Formato de Ensayo Sugeridas
Guía para responder: Empieza explicando el concepto de tensión angular. Luego, para cada tamaño de anillo (3, 4, 5 y 6 miembros), describe cómo se desvían sus ángulos de enlace internos del ángulo ideal de 109.5° de un carbono tetraédrico. Concluye cómo esta desviación (tensión angular) influye directamente en su estabilidad relativa.
Guía para responder: Describe la geometría de cada conformación (silla y bote). Luego, analiza las fuentes de tensión para cada una: tensión angular (dónde está presente o ausente) y tensión torsional (eclipsamiento). Menciona las repulsiones estéricas ("interacciones bandera" en el bote). Finalmente, explica claramente por qué la silla es la más estable (ángulos casi ideales, sin tensión torsional significativa).
Guía para responder: Divide la respuesta en dos partes: monosustituidos y disustituidos. Para monosustituidos, explica cómo el anillo se convierte en la cadena principal y el grupo alquilo en el sustituyente. Para disustituidos, detalla la numeración para obtener los localizadores más bajos y cómo resolver ambigüedades por orden alfabético. ¡Asegúrate de incluir un ejemplo claro para cada caso!
Guía para responder: Más allá de la tensión angular, discute cómo la tensión torsional contribuye a la inestabilidad en anillos pequeños (ciclopropano, ciclobutano) debido al eclipsamiento. Menciona que en anillos más grandes, aunque la tensión angular disminuye, pueden surgir otras tensiones (como estéricas) que influyen en la conformación y estabilidad general. Relaciona estos tipos de tensión con la estabilidad observada en anillos de diferentes tamaños.
Guía para responder: Primero, recuerda la regla clave: si la cadena abierta de carbonos tiene más átomos que el anillo, la cadena abierta es la principal y el anillo se considera un sustituyente cicloalquilo. Propón un ejemplo específico (por ejemplo, "1-ciclopropilbutano" o "3-ciclopentilhexano"). Luego, explica detalladamente por qué, en tu ejemplo, el anillo se nombra como sustituyente (cicloalquilo) y no como la cadena principal.