Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
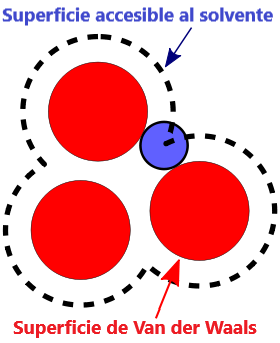
- Superficie VDW, la superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Alcanos

Escuchar Podcast
Haz clic en el botón para cargar y reproducir el audio.
Las propiedades de los alcanos dependen de su estructura: sus moléculas presentan enlaces covalentes y están constituidos por elementos que poseen electronegatividades relativamente iguales: carbono (2.5); hidrógeno (2.1). Esto hace que las moléculas de los alcanos sean "esencialmente" no polares.
Las fuerzas que mantienen unidas a las moléculas no polares (fuerzas de Van der Waals) son débiles, de alcance limitado y actúan principalmente en las superficies moleculares donde las moléculas tienen mayor contacto. Esto hace que cuanto más grande sea una molécula, más intensas sean las fuerzas intermoleculares, lo que incide en algunas propiedades físicas.
Una sustancia se encuentra en estado líquido y no en estado gaseoso debido a que existen fuerzas de cohesión entre las moléculas (fuerzas de atracción intermoleculares) que son mayores en el estado líquido que en fase gaseosa
¿En qué forma se relaciona la estructura molecular con las propiedades físicas de los compuestos?. Los estados sólido, líquido y gaseoso de un compuesto no representan diferencias en la estructura de las moléculas individuales; más bien, representan variaciones en la disposición de las moléculas. En un sólido, las moléculas están acomodadas de manera muy compacta y están relativamente inmovilizadas en una red cristalina ordenada. Las fuerzas de atracción entre moléculas alcanzan un máximo. En el estado líquido, las atracciones moleculares continúan existiendo, pero las moléculas son móviles; tienen más energía cinética. La movilidad molécular en la fase de vapor es tan grande que prácticamente no existen atracciones moleculares y cada molécula es, en teoría, independiente de las otras. Se requiere energía, en forma de calor, para suministrar a las moléculas el ímpetu y movilidad que necesitan para desprenderse de la red cristalina y formar un líquido o para romper todas las fuerzas de atracción y convertirse en vapor.
A temperatura ambiente (26° C) y una atmósfera de presión, el metano, el etano, el propano y el butano son gases a temperatura ambiente. Los alcanos no ramificados desde el (C5H12) al (C17H36) son líquidos, y a partir de C18 en adelante, son sólidos.
Simulador de orbitales y polaridad del etano ... Hacer clic aquí
Punto de Ebullición
Los alcanos normales muestran un aumento constante en el punto de ebullición al aumentar el peso molecular. Si el alcano es ramificado disminuye notablemente el punto de ebullición y además cuanto más numerosas sean las ramificaciones, menor es su valor. En la siguiente gráfica se puede observar una comparación entre los puntos de ebullición de alcanos sin ramificación y sus isómeros 2-metil-ramificados. Los isómeros, por supuesto, tienen el mismo número de átomos y electrones, pero una molécula de un alcano ramificado tiene un área de superficie más pequeña que la de un alcano no ramificado. La forma más extendida de un alcano no ramificado permite más puntos de contacto para las asociaciones intermoleculares. Comparemos los puntos de ebullición del pentano (36° C), 2-metilbutano (28°C) y 2,2-dimetilbutano (9° C). Las formas de estos isómeros son claramente evidentes. El pentano tiene estructura más extendida y la mayor área de superficie capaz de "pegarse" a otras moléculas mediante fuerzas de atracción débiles, tiene el punto de ebullición más alto. El 2,2-dimetilpropano tiene la estructura más compacta, establece menos atracciones y tiene el punto de ebullición más bajo.
¡Atención!
Simulador de comparación de puntos de ebullición ... Hacer clic aquíPropiedades Físicas de los Alcanos
Los alcanos son hidrocarburos saturados, lo que significa que están compuestos únicamente por átomos de carbono e hidrógeno unidos por enlaces simples. Su estructura más simple los convierte en una base fundamental para entender la química orgánica. Las propiedades físicas de los alcanos están influenciadas principalmente por su tamaño molecular (número de átomos de carbono) y la forma de su cadena (lineal o ramificada).
En esta aplicación, exploraremos cómo cambian las propiedades físicas clave, como el punto de ebullición, el punto de fusión y la densidad, a medida que aumenta el número de átomos de carbono en la cadena de alcanos, y cómo la ramificación afecta estas propiedades.
Estado Natural de los Alcanos
En condiciones de temperatura y presión ambiente (aproximadamente 25°C y 1 atmósfera), el estado físico de los alcanos depende de su masa molecular:
- Alcanos con 1 a 4 átomos de carbono: Son gases. Ejemplos incluyen el metano ($CH_4$), etano ($C_2H_6$), propano ($C_3H_8$) y butano ($C_4H_{10}$).
- Alcanos con 5 a 17 átomos de carbono: Son líquidos. La gasolina y el queroseno son mezclas de alcanos líquidos, como el pentano ($C_5H_{12}$) o el decano ($C_{10}H_{22}$).
- Alcanos con 18 o más átomos de carbono: Son sólidos. La parafina es un ejemplo de alcanos sólidos de cadena larga, como el octadecano ($C_{18}H_{38}$).
Esta tendencia se debe al aumento de las fuerzas de dispersión de London (fuerzas de Van der Waals) a medida que la superficie de contacto entre las moléculas se incrementa con el tamaño de la cadena.
Propiedades Físicas Clave
Punto de Ebullición (°C)
El punto de ebullición de los alcanos aumenta a medida que se incrementa el número de átomos de carbono en la cadena. Esto se debe a que las moléculas más grandes tienen una mayor superficie de contacto, lo que permite interacciones más fuertes de las fuerzas de dispersión de London entre ellas. Superar estas fuerzas requiere más energía, lo que se traduce en un punto de ebullición más alto.
Por ejemplo, el metano ($CH_4$) tiene un punto de ebullición de $-161.5 \text{ °C}$, mientras que el n-pentano ($C_5H_{12}$) ebulle a $36.1 \text{ °C}$ y el n-decano ($C_{10}H_{22}$) a $174.0 \text{ °C}$.
La ramificación de la cadena disminuye el punto de ebullición, ya que reduce la superficie de contacto efectiva entre las moléculas, debilitando las fuerzas intermoleculares. Por ejemplo, el n-pentano ($C_5H_{12}$) tiene un punto de ebullición de $36.1 \text{ °C}$, mientras que su isómero ramificado, el isopentano (2-metilbutano), ebulle a $27.8 \text{ °C}$, y el neopentano (2,2-dimetilpropano), aún más ramificado, ebulle a $9.5 \text{ °C}$.
Fuente de datos: Valores generales y tendencias aproximadas de la literatura química.
Punto de Fusión (°C)
El punto de fusión de los alcanos también tiende a aumentar con el número de átomos de carbono. Sin embargo, la tendencia no es tan regular como la del punto de ebullición. El punto de fusión depende de la eficiencia con la que las moléculas pueden empaquetarse en una red cristalina sólida.
Las moléculas más simétricas o que pueden empaquetarse de manera más compacta en el estado sólido tienden a tener puntos de fusión más altos. Por ejemplo, el n-hexano ($C_6H_{14}$) tiene un punto de fusión de $-95.3 \text{ °C}$, mientras que el n-heptano ($C_7H_{16}$) tiene un punto de fusión de $-90.6 \text{ °C}$. Curiosamente, el neopentano ($C_5H_{12}$), a pesar de ser muy ramificado, tiene un punto de fusión relativamente alto de $-16.6 \text{ °C}$ debido a su alta simetría que permite un empaquetamiento eficiente.
Fuente de datos: Valores generales y tendencias aproximadas de la literatura química.
Densidad (g/mL)
La densidad de los alcanos líquidos es generalmente menor que la del agua (aproximadamente $1 \text{ g/mL}$) y aumenta gradualmente con el incremento del número de átomos de carbono. A medida que la cadena de carbono se alarga, la masa molecular aumenta más rápidamente que el volumen molar, lo que lleva a un incremento en la densidad.
Por ejemplo, el n-pentano tiene una densidad de $0.626 \text{ g/mL}$ y el n-decano de $0.730 \text{ g/mL}$. Todos los alcanos son menos densos que el agua y, por lo tanto, flotarán sobre ella.
Fuente de datos: Valores generales y tendencias aproximadas de la literatura química.
Solubilidad
Los alcanos son compuestos no polares. Por lo tanto, son insolubles en agua (un disolvente polar) pero son solubles en disolventes orgánicos no polares, como éter, benceno, tetracloruro de carbono y otros hidrocarburos. La regla general "lo semejante disuelve a lo semejante" se aplica aquí.
Efecto de la Ramificación en las Propiedades Físicas
La ramificación en la cadena de un alcano tiene un impacto significativo en sus propiedades físicas:
- Punto de Ebullición: La ramificación disminuye la superficie de contacto entre las moléculas, lo que reduce las fuerzas de dispersión de London y, por lo tanto, baja el punto de ebullición. Los isómeros más ramificados tienen puntos de ebullición más bajos. Por ejemplo, el n-hexano ($C_6H_{14}$) tiene un punto de ebullición de $68.7 \text{ °C}$, mientras que el 2,2-dimetilbutano (un isómero ramificado del hexano) tiene un punto de ebullición de $49.7 \text{ °C}$.
- Punto de Fusión: La ramificación puede tener un efecto más complejo. Las moléculas más compactas y simétricas (aunque ramificadas) pueden empaquetarse más eficientemente en el estado sólido, lo que puede resultar en puntos de fusión más altos que sus isómeros lineales o menos ramificados. Un ejemplo notable es el neopentano, mencionado anteriormente.
- Densidad: La ramificación generalmente disminuye la densidad ligeramente, ya que las moléculas ramificadas tienden a ser menos compactas que sus isómeros lineales.
Gráfica Interactiva de Propiedades (Alcanos Lineales)
Selecciona una propiedad para visualizar su tendencia en función del número de átomos de carbono en alcanos lineales.
Fuente de datos: Valores aproximados e ilustrativos de la literatura química, basados en tendencias generales.
Gráfica Interactiva de Isómeros de Alcanos (C5 y C6)
Selecciona una propiedad para comparar visualmente las diferencias entre isómeros de alcanos con el mismo número de carbonos (C5 y C6).
Haz clic en los elementos de la leyenda (los cuadros de color) para mostrar u ocultar las barras correspondientes en la gráfica.
Fuente de datos: PubChem.
Propiedades Físicas de los Cicloalcanos
Los cicloalcanos son hidrocarburos saturados que contienen uno o más anillos de átomos de carbono. Su estructura cíclica les confiere propiedades físicas ligeramente diferentes en comparación con sus análogos de cadena abierta (alcanos lineales) con el mismo número de átomos de carbono.
- Punto de Ebullición: Generalmente, los cicloalcanos tienen puntos de ebullición más altos que los alcanos de cadena abierta con el mismo número de carbonos. Esto se debe a que la estructura cíclica es más rígida y compacta, lo que permite un empaquetamiento más eficiente y una mayor superficie de contacto entre las moléculas, resultando en fuerzas de dispersión de London más fuertes. Por ejemplo, el ciclohexano ($C_6H_{12}$) tiene un punto de ebullición de $80.7 \text{ °C}$, mientras que el n-hexano ($C_6H_{14}$) tiene un punto de ebullición de $68.7 \text{ °C}$.
- Punto de Fusión: Similar al punto de ebullición, los puntos de fusión de los cicloalcanos suelen ser más altos que los de sus alcanos acíclicos correspondientes. La simetría y la capacidad de empaquetamiento en el estado sólido juegan un papel crucial, y las estructuras cíclicas a menudo se empaquetan de manera más compacta. Por ejemplo, el ciclohexano ($C_6H_{12}$) tiene un punto de fusión de $6.5 \text{ °C}$, significativamente más alto que el n-hexano ($C_6H_{14}$) con $-95.3 \text{ °C}$.
- Densidad: Los cicloalcanos son más densos que los alcanos de cadena abierta con el mismo número de carbonos. La estructura cíclica más compacta permite que más masa se empaquete en un volumen dado. Por ejemplo, la densidad del ciclohexano es de $0.779 \text{ g/mL}$, mientras que la del n-hexano es de $0.659 \text{ g/mL}$. Al igual que los alcanos, los cicloalcanos son menos densos que el agua.
- Solubilidad: Al igual que los alcanos, los cicloalcanos son compuestos no polares, lo que los hace insolubles en agua pero solubles en disolventes orgánicos no polares.
Fuente de datos: Valores generales y tendencias aproximadas de la literatura química.
Comparación de Propiedades Físicas: Alcanos vs Cicloalcanos
Los cicloalcanos tienen propiedades físicas que difieren de los alcanos de cadena abierta con el mismo número de átomos de carbono debido a su estructura cíclica. Esta sección compara cómo varían el punto de ebullición, el punto de fusión y la densidad entre ambos tipos de hidrocarburos.
Utiliza el menú desplegable para seleccionar la propiedad que deseas comparar. Haz clic en los elementos de la leyenda (los cuadros de color "Alcanos" o "Cicloalcanos") para mostrar u ocultar las barras correspondientes en la gráfica. Los valores de temperatura se comparan con el punto de congelación (0 °C) y ebullición (100 °C) del agua.
Fuente de datos: PubChem y literatura química general. Los valores de densidad se indican a la temperatura de medición.
Guía de Estudio
✨ Guía de Estudio: Propiedades Físicas de Alcanos y Cicloalcanos ✨
Haz clic en cualquier pregunta o término para revelar la respuesta o definición. Al abrir un elemento, los demás se cerrarán automáticamente dentro de su respectiva sección.
Introducción
Bienvenidos a la Guía
Esta guía interactiva te ayudará a comprender mejor las **propiedades físicas** de los **alcanos** y **cicloalcanos**.
Explora las diferentes secciones para repasar conceptos, poner a prueba tus conocimientos y consolidar el vocabulario clave.
❓ Quiz (Respuesta Corta)
Instrucciones: Responde cada pregunta en 2-3 frases.
✍️ Preguntas en Formato de Ensayo
Guía para responder: Considera cómo la ausencia de polaridad limita las interacciones a fuerzas de Van der Waals, y cómo la superficie de contacto entre moléculas afecta la energía necesaria para cambiar de estado.
Guía para responder: Enfócate en cómo la ramificación reduce el área de superficie para las interacciones, y cómo la simetría afecta la capacidad de empaquetamiento en el estado sólido.
Guía para responder: Describe la relación entre la fortaleza de las fuerzas intermoleculares y la libertad de movimiento de las moléculas en cada estado.
Guía para responder: Compara la flexibilidad de las cadenas abiertas con la rigidez de los anillos, y cómo esto influye en las interacciones intermoleculares y el empaquetamiento.
Guía para responder: A medida que aumenta el tamaño de la molécula, considera cómo cambia la masa por unidad de volumen y su interacción con disolventes.