Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
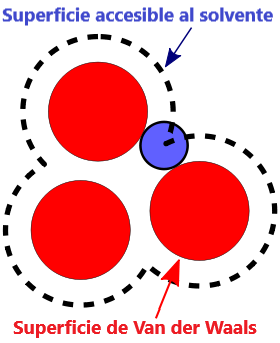
- Superficie VDW, la superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Alcanos

Escuchar Podcast
Haz clic en el botón para cargar y reproducir el audio.

Los hidrocarburos saturados se consideran frecuentemente como los compuestos básicos de la química orgánica, ya que los demás compuestos orgánicos que se conocen pueden considerarse como derivados de ellos. Los hidrocarburos, como su nombre lo indica, son compuestos constituidos solamente por átomos de carbono e hidrógeno. El adjetivo, saturados, describe el tipo de enlaces de la molécula hidrocarbonada. Significa que cada átomo de carbono se encuentra unido en forma covalente a cuatro átomos mediante enlaces sencillos. Estos compuestos también se conocen como hidrocarburos parafínicos o alcanos. El nombre parafina (del latín, parum affinis, poca actividad) alude a su naturaleza no reactiva. El nombre alcano es el nombre genérico para esta clase de compuestos.
Los hidrocarburos saturados pertenecen a la serie alifática de compuestos. (Las otras dos series, son la aromática y heterocíclica. Como muchos de los primeros hidrocarburos alifáticos que se estudiaron se obtuvieron a partir de los ácidos grasos, el nombre alifático (del griego, aleiphatos, grasa), se les aplicó para indicar su origen. En la actualidad, los compuestos alifáticos comprenden a todos los hidrocarburos de cadena abierta e hidrocarburos cíclicos, así como sus derivados.
Clases de hidrocarburos según el tipo de enlace
Los hidrocarburos tanto lineales como ramificados según la naturaleza del enlace, pueden clasificarse como:

Clasificación de los hidrocarburos.
Clasificador Interactivo de Hidrocarburos
Tipos de Hidrocarburos
Prueba Interactiva
Pon a prueba tus conocimientos sobre la clasificación de hidrocarburos.
Clasificación de los hidrocarburos.
- Alcanos o hidrocarburos saturados: compuestos formados únicamente por carbono e hidrógeno unidos por enlaces covalentes sencillos entre los carbonos.
- Alquenos: hidrocarburos insaturados que tienen un enlace covalente doble entre dos átomos de carbonos.
- Alquinos: hidrocarburos insaturados que tienen un enlace covalente triple entre dos átomos de carbono.

Propano

Propeno

Propino
Clases de hidrocarburos según la forma de la cadena
Los hidrocarburos, se clasifican de la siguiente forma:
Hidrocarburos de cadena abierta o acíclicos
- Lineales o normales: Son cadenas con átomos de carbono unidos cada uno a un máximo de dos carbonos.
- Ramificados: Cada átomo de carbono se puede unir a 3 o 4 átomos de carbono.

Propano

Neopentano
Hidrocarburos de cadena cerrada o cíclicos
Están formados por cadenas de átomos que se cierran formando uno o varios anillos o ciclos con tres o más carbonos. Pueden ser:
- alicíclicos: Si poseen propiedades similares a los compuestos alifáticos como el
.
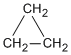
Ciclopropano
- Aromáticos: Si contienen sistemas "aromáticos". Un ejemplo de este tipo de compuestos es el .

Benceno
Guía de Estudio
Guía de Estudio Interactiva
Alcanos e Hidrocarburos
Quiz de Comprensión
Instrucciones: Haz clic en cada pregunta para revelar la respuesta. Al seleccionar una nueva pregunta, las demás se cerrarán.
Preguntas de Ensayo
Glosario de Términos Clave
Instrucciones: Haz clic en cada término para revelar su definición. Al seleccionar un nuevo término, los demás se cerrarán.