Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
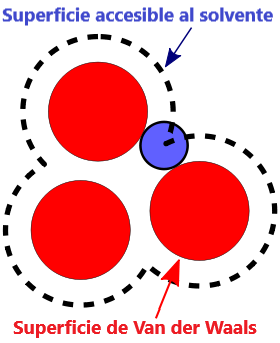
- Superficie VDW, la superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Alcanos

Escuchar Podcast
Haz clic en el botón para cargar y reproducir el audio.
Clases de Reacciones Orgánicas
En términos generales, las reacciones de la química orgánica se pueden organizar con base en dos criterios: qué tipos de reacciones se presentan y cómo se producen. Primero veamos las clases de reacciones que se llevan a cabo. Hay cuatro tipos generales de reacciones orgánicas: adición, eliminación, sustitución y rearreglo.
Reacciones de Adición
Las reacciones de adición ocurren cuando dos reactivos se unen y forman un producto nuevo, sin que "sobren" átomos. Se puede generalizar el proceso como se puede observar a continuación en la siguiente película. Como ejemplo de una reacción de adición está la reacción de un alqueno, como el etileno, con HBr para formar un bromuro de alquilo.
Reacciones de Eliminación
Las reacciones de eliminación , en cierta forma, lo contrario de las de adición. Las eliminaciones se presentan cuando un solo reactivo se descompone en dos productos. Un ejemplo de una reacción de eliminación es la de un halogenuro de alquilo y una base, la cual produce un ácido y un alqueno.
Reacciones de Sustitución
Las reacciones de sustitución se presentan cuando dos reactivos intercambian partes y originan dos productos nuevos. Como ejemplo de una reacción de sustitución tenemos la de un alcano con Cl2 en presencia de luz ultravioleta; el resultado es un cloruro de alquilo. Un ejemplo de este tipo de reacción es cuando un átomo de Cl del Cl2 sustituye un átomo de H del alcano y se forman dos productos nuevos.
Reacciones de Rearreglo o Transposición
Las reacciones de transposición se pueden representar por medio del siguiente esquema generan, y suceden cuando un solo reactivo sufre una reorganización de enlaces y átomos, para dar lugar a un producto isomérico. Un ejemplo de reacción de rearreglo, o transposición, es la conversión del 1-buteno, un alqueno, en su isómero, el 2-buteno, cuando se trata con un catalizador ácido.
Mecanismos de Reacción
Una descripción general de la forma en que se realiza una reacción se llama mecanismo de reacción. En este se describe con detalle lo que sucede exactamente en cada etapa de una transformación química, cuáles enlaces se rompen y en qué orden, cuáles se forman y en qué orden, y cuáles son las velocidades relativas de las etapas. También, un mecanismo completo debe tener en cuenta todos los reactivos que intervienen, todos los productos que se originan y la cantidad de cada uno.
En todas las reacciones químicas hay ruptura y formación de enlaces. Cuando dos moléculas se unen, reaccionan y forman productos, se rompen enlaces específicos en las moléculas reaccionantes y se crean determinados enlaces en las moléculas producidas. En esencia hay dos modos en que se puede romper un enlace covalente de dos electrones:
- Electrónicamente simétrico: Cuando un electrón permanece con cada fragmento de producto. Se dice que este rompimiento es homolítico.
- Electrónicamente asimétrico: cuando ambos electrones enlazantes quedan con un fragmento de producto y dejan al otro con un orbital vacío. Se dice que este rompimiento es heterolítico.
Así como hay dos modos en que se puede romper un enlace, también existen dos en que se puede producir un enlace covalente de dos electrones:
- Forma homogénica, electrónicamente simétrica, cuando cada reactivo aporta un electrón al nuevo enlace.
- Forma heterogénica, electrónicamente asimétrica , cuando uno de los reactivos aporta ambos electrones enlazantes al nuevo enlace.
Los procesos que comprenden rompimiento y formación simétricos de enlace se llaman reacciones por radicales. Un radical (llamado a veces "radical libre") es una especie química neutra que contiene una cantidad impar de electrones y, como consecuencia, tiene un solo electrón no apareado en uno de sus orbitales. Los procesos en que hay ruptura y formación asimétrica de enlaces se denominan reacciones polares. En ellas intervienen especies que tienen una cantidad par de electrones, por lo que sólo tienen pares de electrones en sus orbitales. Los procesos polares son la clase más común de reacciones en química orgánica.
Ejemplo de un mecanismo de reacción, adición a un doble enlace

¡Atención!
Simulador del mecanismo de reacción de adición a un doble enlace.Reactividad
Los alcanos tienen una reactividad baja comparándolos con otros hidrocarburos debido a que sus moléculas están formadas por enlaces sigma difíciles de romper, sin embargo, la reactividad depende de la elección del reactivo y de las siguientes condiciones:
- En fase gaseosa, reaccionan a temperatura y presión alta.
- En fase líquida, son relativamente inertes a temperatura y presión moderada.
Los alcanos son tan poco reactivos que George A. Olah, de la universidad de Southern California fue galardonado con el premio Nobel de Química en 1994 en parte por el desarrollo de sustancias nuevas que reaccionen con los alcanos.
Combustión de Alcanos
Una reacción de combustión es un cambio químico en el cual un compuesto se combina con oxígeno (O2) para producir calor, luz y productos gaseosos. Por ejemplo, cuando la fuente de O2 es abundante, el metano sufre una combustión completa.
En este ejemplo, se puede observar que se necesitan dos moléculas de O2 para la combustión de Una molécula de CH4. Si hay suficiente oxígeno, habrá una combustión completa en la que todo el metano se transforma en CO2 y H2O. La relación entre la cantidad de combustible y de comburente para una combustión completa es la relación estequiométrica. En este caso, esta relación es 1:2. Por debajo de este nivel, la combustión de un material puede seguir produciéndose pero llegará un momento en el que el oxígeno se agote y la reacción se detenga o se de parcialmente. La combustión habrá sido incompleta.
En la combustión incompleta de hidrocarburos, además de producirse CO2, H2O y de quedar combustible sin reaccionar, se pueden producir otras sustancias derivadas. Por ejemplo, el hollín son partículas sólidas de pequeño tamaño, formadas principalmente por carbono impuro, que se producen como consecuencia de la combustión incompleta de la madera, carbón y otros combustibles hidrocarburados. Entonces, la forma más simple de determinar si la combustión es completa, es ver que sólo se haya producido CO2 y H2O, y si es incompleta, si se ha producido C o CO o ambos.

Ejemplos de combustión incompleta.
Halogenación
Cuando se almacena una mezcla de un alcano y cloro gaseoso, a bajas temperaturas y en la oscuridad, no ocurre ninguna reacción. Sin embargo, con la presencia de luz solar o a altas temperaturas, se produce una reacción exotérmica compleja por radicales libres. Uno o más de los átomos de hidrógeno del alcano se ven reemplazados por átomos de cloro (la reacción de halogenación también puede llevarse a cabo con bromo). Esta reacción se puede representar por la siguiente ecuación general . Aunque la reacción de cloración parece ser simple, no lo es. En la cloración del metano, el producto clorometano, aún posee tres átomos de hidrógeno que pueden ser desplazados si encuentran otras moléculas de Cl2. Así, la reacción puede continuar hasta que sean desplazados todos los átomos de hidrógeno.

Halogenación del metano.
Mecanismo de la Halogenación

¡Atención!
Simulador del mecanismo de reacción de halogenación por radicales libres del ciclohexano.Reacción de bromación de un alcano, alqueno y benceno.
Reacción de n-pentano con bromo.
Guía de Estudio
📚 Guía de Estudio Interactiva 📚
Repaso del Material Fuente: Reacciones Orgánicas Fundamentales y Mecanismos. Haz clic en cualquier pregunta o término para revelar la respuesta o definición. Al abrir un elemento, los demás se cerrarán automáticamente dentro de su respectiva sección.
Quiz (Preguntas Cortas)
Instrucciones: Haz clic en cada pregunta para ver la respuesta. Solo una respuesta se mostrará a la vez.
Preguntas en Formato de Ensayo Sugeridas
Instrucciones: Haz clic en cada pregunta para ver una sugerencia. Solo una sugerencia se mostrará a la vez.
Sugerencia: Piensa en la definición de cada tipo de reacción: adición une, eliminación separa. Reflexiona sobre cómo son procesos opuestos y qué sucede con los enlaces en cada caso.
Sugerencia: Recuerda qué sucede con los electrones en cada tipo de ruptura. ¿Qué especies se forman en cada caso y cómo se relacionan con las reacciones por radicales y polares?
Sugerencia: Céntrate en la naturaleza de los enlaces sigma de los alcanos. ¿Cómo las condiciones externas o la presencia de halógenos pueden proporcionar la energía o las especies necesarias para iniciar una reacción?
Sugerencia: Distingue la diferencia clave en la cantidad de oxígeno disponible. ¿Qué productos se forman en cada escenario y por qué se producen subproductos como el hollín o el monóxido de carbono en la incompleta?
Sugerencia: Recuerda las tres etapas principales de una reacción por radicales libres: iniciación, propagación y terminación. ¿Qué papel juega la luz UV en este proceso?
Glosario de Términos Clave
Instrucciones: Haz clic en cada término para ver su definición. Solo una definición se mostrará a la vez.