Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
- Superficie VDW, la superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.

Aminoácidos
Atención
Alerta!
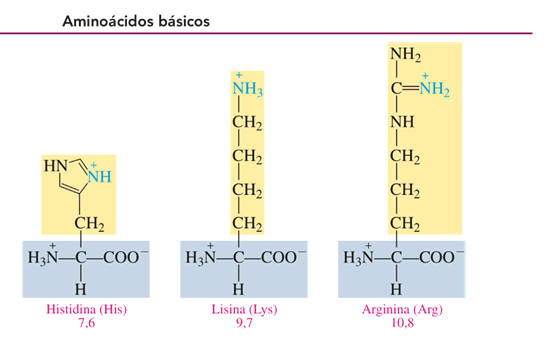
Los aminoácidos se agrupan en la figura según las propiedades de sus cadenas laterales.
Escuchar Podcast
Haz clic en el botón para cargar y reproducir el audio.
Los aminoácidos con cadenas laterales no polares son hidrófobos, en tanto que aquéllos con cadenas laterales polares son hidrófilos. Los aminoácidos ácidos tienen cadenas laterales con un grupo carboxilo. En el pH celular, el grupo carboxilo se disocia de manera que el grupo R tiene una carga negativa. Los aminoácidos básicos tienen carga positiva debido a la disociación del grupo amino en su cadena lateral. Las cadenas laterales ácidas o básicas son iónicas y por tanto, son hidrófilas. Además de los veinte aminoácidos conocidos, algunas proteínas contienen otros aminoácidos menos comunes. Estos se producen por la modificación de aquéllos, al formar parte de una proteína. Por ejemplo, la lisina y la prolina pueden convertirse en hidroxilisina e hidroxiprolina respectivamente después de incorporarse al colágeno. Estos aminoácidos dan origen a enlaces cruzados entre las cadenas peptídicas del colágeno. Dichos enlaces aportan la firmeza y la fuerza de las moléculas del colágeno, que es uno de los principales componentes del cartílago, del hueso y de otros tejidos conectivos.

No Polares
Atención
Alerta!
Un aminoácido es no polar cuando el grupo R es H, alquilo, aromático o tioéter.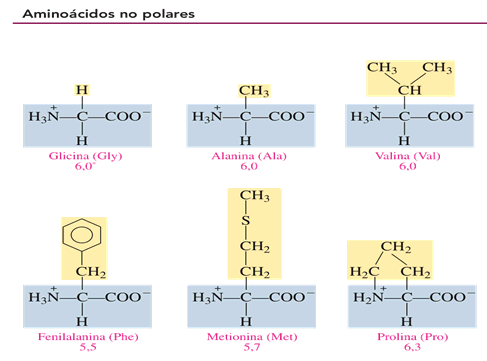










Polares
Atención
Alerta!
Un aminoácido es polar cuando el grupo R es un alcohol, fenol, un tiol o una amida.







Ácidos y Básicos
Atención
Alerta!
Un aminoácido es ácido cuando el grupo R es un ácido carboxílico y básico cuando el grupo R es una amina.





Guía de Estudio
🧪 Guía de Estudio: Clasificación de Aminoácidos 🧪
Este material detalla la clasificación de los aminoácidos según las propiedades de sus cadenas laterales (grupos R), lo que determina su interacción con el agua y su carga a pH celular. Se exploran las categorías de aminoácidos no polares (hidrófobos), polares (hidrófilos), ácidos y básicos. Además, se abordan los aminoácidos menos comunes, que se forman por modificación post-traduccional de los aminoácidos estándar y cumplen funciones cruciales, como en el caso del colágeno.
❓ Quiz de Preguntas Cortas
✍️ Preguntas de Formato Ensayo
Guía para responder: Detalle cómo los grupos R no polares (alquilo, aromático) tienden a ubicarse en el interior de las proteínas, lejos del agua, mientras que los polares (alcohol, amida) se sitúan en la superficie para interactuar con el entorno acuoso.
Guía para responder: Explique que el grupo carboxilo (-COOH) de los aminoácidos ácidos pierde un protón para convertirse en -COO⁻, mientras que el grupo amino (-NH₂) de los básicos gana un protón para ser -NH₃⁺. La presencia de estas cargas aumenta drásticamente la solubilidad en agua.
Guía para responder: Detalle que estos aminoácidos se forman por modificación post-traduccional. En el colágeno, la hidroxilación de prolina y lisina permite la formación de enlaces cruzados que estabilizan la triple hélice de la proteína.
Guía para responder: Argumente que los enlaces cruzados proporcionan la fuerza tensil al colágeno. Su ausencia resultaría en tejidos conectivos débiles y frágiles, como se observa en enfermedades como el escorbuto (deficiencia de vitamina C, necesaria para la hidroxilación).
Guía para responder: Explique que estas modificaciones actúan como un "interruptor" molecular, activando o desactivando proteínas, marcándolas para su degradación, o alterando su localización y capacidad de interacción, expandiendo así el repertorio funcional de las proteínas.