Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
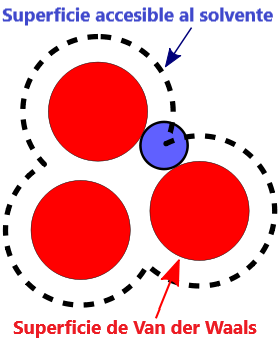
- Superficie VDW, la superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Alquinos

Escuchar Podcast
Haz clic en el botón para cargar y reproducir el audio.
Los alquinos son hidrocarburos cuyas moléculas contienen al menos un triple enlace carbono-carbono, característica distintiva de su estructura.
Los alquinos no cíclicos tienen la fórmula molecular CnH2n-2. Tienen una proporción de hidrógeno menor que los alquenos por esto presentan un grado mayor de insaturación.
Los alquinos presentan hibridación sp; los orbitales son más pequeños que los orbitales sp2 de los alquenos y los sp3 de los alcanos. En consecuencia, el carbono con hibridación sp, forma enlaces más cortos que los otros y facilita la ruptura heterolítica de del enlace C-H.
El acetileno es una molécula lineal con una distancia de enlace carbono-carbono de 1.20 Å y una distancia de enlace carbono-hidrógeno de 1.06 Å, y con ángulos de enlace de 180°.
Hay un progresivo acortamiento en la longitud del enlace carbono-carbono en la serie etano (1.54 Å), etileno (1.34 Å) y (1.20 Å). La longitud del enlace carbono-hidrógeno también disminuye.
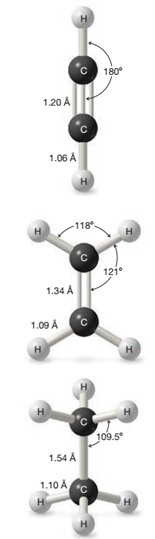
Los orbitales sp2 tienen la misma forma de los sp3 pero son más pequeños. Por lo tanto el doble enlace es más corto ( 1.34 Å) que el enlace sencillo ( 1.53-1.54 Å).
Propiedades Físicas de Alcanos, Alquenos y Alquinos
Explora cómo el número de carbonos y la posición del triple enlace afectan las propiedades.
¿Qué son las Propiedades Físicas de los Hidrocarburos?
Las propiedades físicas de los hidrocarburos (compuestos formados solo por carbono e hidrógeno) son características que podemos observar o medir sin cambiar la composición química de la sustancia. Estas propiedades nos ayudan a entender cómo se comportan y para qué pueden ser utilizados.
Estado Natural
El estado natural de una sustancia (sólido, líquido o gaseoso) a una temperatura y presión dadas depende de la fuerza de las interacciones entre sus moléculas. A temperatura ambiente (25°C):
- Los hidrocarburos con pocos carbonos (C1 a C4) suelen ser gases. Por ejemplo, el metano (C1) y el butano (C4) son gases.
- Los hidrocarburos con un número intermedio de carbonos (C5 a C17) suelen ser líquidos. Por ejemplo, el octano (C8) es un líquido.
- Los hidrocarburos con muchos carbonos (C18 en adelante) suelen ser sólidos. Por ejemplo, la parafina, una mezcla de alcanos de cadena larga, es un sólido.
Punto de Fusión (PF)
El punto de fusión es la temperatura a la cual una sustancia cambia de estado sólido a líquido. Refleja la energía necesaria para superar las fuerzas que mantienen las moléculas en una estructura cristalina sólida. Generalmente, a mayor número de carbonos y mayor simetría (lo que permite un mejor empaquetamiento molecular), mayor es el punto de fusión. Por ejemplo, el decano (C10) tiene un punto de fusión más alto que el propano (C3).
Punto de Ebullición (PE)
El punto de ebullición es la temperatura a la cual una sustancia cambia de estado líquido a gaseoso. Indica la energía necesaria para que las moléculas escapen de la fase líquida y pasen a la fase de vapor. Depende principalmente de las fuerzas de dispersión de London (fuerzas de van der Waals), que aumentan con el tamaño molecular y la superficie de contacto. Por ejemplo, el hexano (C6) tiene un punto de ebullición más alto que el etano (C2).
Densidad
La densidad es una medida de la cantidad de masa que hay en un volumen determinado de una sustancia (masa/volumen). Para los hidrocarburos, la densidad generalmente aumenta con el número de carbonos, ya que la masa molecular aumenta más rápidamente que el volumen ocupado por las moléculas. Los hidrocarburos son típicamente menos densas que el agua (densidad aproximada de 1 g/mL). Por ejemplo, el pentano (C5) es menos denso que el octano (C8).
Solubilidad
La solubilidad es la capacidad de una sustancia (soluto) para disolverse en otra (disolvente) y formar una mezcla homogénea (disolución). En química, una regla general es "lo semejante disuelve a lo semejante", lo que significa que las sustancias polares tienden a disolverse en disolventes polares, y las sustancias no polares en disolventes no polares.
- Los hidrocarburos (alcanos, alquenos y alquinos) son en su mayoría **compuestos no polares** o de muy baja polaridad, ya que los enlaces carbono-carbono y carbono-hidrógeno tienen una diferencia de electronegatividad muy pequeña.
- Por lo tanto, son **insolubles en agua** (que es un disolvente polar) y forman dos fases distintas cuando se mezclan.
- Son **solubles en disolventes no polares**, como el benceno, el éter, el tetracloruro de carbono, o en otros hidrocarburos. Por ejemplo, el aceite (una mezcla de hidrocarburos) no se mezcla con el agua, pero se disuelve en gasolina.
Fuente de Datos y Metodología
Los valores mostrados en esta aplicación son aproximaciones calculadas basándose en tendencias generales observadas en la química orgánica. Para una aplicación real que requiera alta precisión, se recomienda obtener los datos directamente de bases de datos químicas fiables.
Por ejemplo, la base de datos de PubChem (una base de datos pública del Centro Nacional de Información Biotecnológica de EE. UU.) contiene una vasta colección de información química, incluyendo propiedades físicas experimentales para miles de compuestos. Aquí te mostramos algunos ejemplos de valores reales obtenidos de PubChem para que puedas compararlos con nuestras aproximaciones:
| Compuesto | Punto de Fusión (°C) | Punto de Ebullición (°C) | Densidad (g/mL) | Fuente (PubChem CID) |
|---|---|---|---|---|
| Etano (Alcano) | -182.8 | -88.6 | 0.546 (líquido) | CID 6324 |
| Eteno (Alqueno) | -169.2 | -103.7 | 0.566 (líquido) | CID 6325 |
| Etino (Alquino) | -80.8 (sublima) | -84.0 (sublima) | 0.618 (líquido) | CID 6326 |
| Butano (Alcano) | -138.4 | -0.5 | 0.601 | CID 7820 |
| 1-Butino (Alquino Terminal) | -125.7 | 8.1 | 0.669 | CID 7846 |
| 2-Butino (Alquino Interno) | -32.3 | 27.2 | 0.694 | CID 7845 |
En una implementación completa, se podría utilizar la API de PubChem para consultar estos valores en tiempo real, lo que garantizaría la mayor precisión posible. Para esta demostración, hemos priorizado la interactividad y la visualización de tendencias con valores aproximados.
Configuración
La posición del triple enlace influye en la simetría molecular, afectando ligeramente la polaridad y las fuerzas intermoleculares, lo que puede resultar en pequeñas variaciones en los puntos de fusión y ebullición. Los alquinos terminales pueden tener una ligera polaridad debido al enlace C(sp)-H.
Propiedades Calculadas (25°C)
Nota: Los valores mostrados son **aproximaciones** basadas en tendencias generales de la química orgánica para fines educativos. No provienen de una base de datos experimental específica.
Alcano (Etano)
- Estado Natural:
- Punto de Fusión: °C
- Punto de Ebullición: °C
- Densidad: g/mL
Alqueno (Eteno)
- Estado Natural:
- Punto de Fusión: °C
- Punto de Ebullición: °C
- Densidad: g/mL
Alquino (Etino)
- Estado Natural:
- Punto de Fusión: °C
- Punto de Ebullición: °C
- Densidad: g/mL
Comparación Gráfica de Puntos de Fusión
Comparación Gráfica de Puntos de Ebullición
Comparación Gráfica de Densidad
Guía de Estudio
📚 Guía de Estudio Detallada: Alquinos y Propiedades de Hidrocarburos 📚
Esta guía explora en profundidad la estructura y características distintivas de los alquinos, así como las propiedades físicas fundamentales de los hidrocarburos en general.
✨ Resumen del Tema
Visión General
Esta guía de estudio está diseñada para profundizar en su conocimiento sobre los **alquinos**, una clase de hidrocarburos con triples enlaces, y para comprender las **propiedades físicas generales de todos los hidrocarburos** (alcanos, alquenos y alquinos). Abordaremos desde la hibridación atómica y la geometría molecular de los alquinos, hasta cómo factores como el número de carbonos, la simetría y las fuerzas intermoleculares influyen en el punto de fusión, ebullición, densidad y solubilidad de estas importantes moléculas orgánicas.
🧪 Sección 1: Alquinos – Estructura y Características Distintivas
- ¿Qué son los alquinos? Son hidrocarburos insaturados que contienen al menos un triple enlace carbono-carbono.
- ¿Cuál es la característica estructural distintiva de los alquinos? La presencia de un triple enlace entre dos átomos de carbono.
- ¿Cuál es la fórmula molecular general para alquinos no cíclicos? La fórmula general es CnH2n-2, donde 'n' es el número de átomos de carbono.
- ¿Qué indica la proporción de hidrógeno en los alquinos en comparación con los alquenos? La menor proporción de hidrógeno en los alquinos (CnH2n-2) en comparación con los alquenos (CnH2n) indica un mayor grado de insaturación.
- ¿Qué tipo de hibridación presentan los carbonos involucrados en un triple enlace? Los carbonos del triple enlace presentan hibridación sp.
- Comparación de tamaños de orbitales: sp, sp2, sp3. Los orbitales sp son los más pequeños y compactos, seguidos por los sp2, y finalmente los sp3 son los más grandes y difusos.
- Impacto del tamaño del orbital sp en la longitud del enlace C-C y C-H. Debido a que los orbitales sp son más pequeños, permiten un mayor solapamiento, lo que resulta en enlaces C-C (triple enlace) y C-H más cortos y fuertes.
- ¿Cómo afecta la hibridación sp a la ruptura heterolítica del enlace C-H? La hibridación sp, al tener un mayor **carácter s** (es decir, una mayor contribución del orbital atómico s), hace que los electrones del enlace C-H estén más cerca del núcleo de carbono. Esto estabiliza la carga negativa que se forma en el carbono cuando el hidrógeno se rompe heterolíticamente como H+, haciendo que los alquinos terminales sean más ácidos que los alcanos y alquenos.
- Describa la forma de la molécula de acetileno. La molécula de acetileno (C2H2) tiene una forma lineal.
- Longitudes de enlace C-C y C-H en el acetileno. La longitud del triple enlace C-C es aproximadamente 1.20 Å y la del enlace C-H es de aproximadamente 1.06 Å.
- Ángulos de enlace característicos en el acetileno. Los ángulos de enlace en el acetileno son de 180°.
- Compare las longitudes de enlace carbono-carbono en etano, etileno y etino.
- Etano (C2H6, enlace sencillo): ≈ 1.54 Å
- Etileno (C2H4, doble enlace): ≈ 1.34 Å
- Etino (C2H2, triple enlace): ≈ 1.20 Å
- ¿Qué tendencia se observa en la longitud del enlace carbono-hidrógeno a medida que aumenta la insaturación? A medida que aumenta la insaturación (de alcano a alqueno a alquino), la longitud del enlace C-H disminuye.
- Relación entre el tamaño de los orbitales híbridos (sp2 vs. sp3) y la longitud de los enlaces dobles y sencillos. Los orbitales sp2 son más pequeños que los sp3. Esto permite un mayor solapamiento en los enlaces dobles (formados por orbitales sp2), haciéndolos más cortos y fuertes que los enlaces sencillos (formados por orbitales sp3).
⚛️ Sección 2: Propiedades Físicas de los Hidrocarburos
- ¿Qué son las propiedades físicas de los hidrocarburos? Son características que pueden ser observadas o medidas sin cambiar la composición química de la sustancia, como el estado natural, punto de fusión, punto de ebullición, densidad y solubilidad.
- ¿Por qué son importantes estas propiedades? Son cruciales para entender el comportamiento de los hidrocarburos, predecir sus usos en la industria (combustibles, disolventes, plásticos) y en la naturaleza, y para diseñar procesos de separación y purificación.
- Describa la relación entre el número de carbonos y el estado natural (gas, líquido, sólido) de los hidrocarburos a temperatura ambiente.
- Hidrocarburos con 1 a 4 carbonos: Generalmente gases.
- Hidrocarburos con 5 a 17 carbonos: Generalmente líquidos.
- Hidrocarburos con 18 o más carbonos: Generalmente sólidos.
- Ejemplos de hidrocarburos para cada estado.
- Gas: Metano (CH4), Etano (C2H6), Propano (C3H8), Butano (C4H10).
- Líquido: Pentano (C5H12), Hexano (C6H14), Octano (C8H18).
- Sólido: Parafina (mezcla de alcanos de cadena larga, ej. C20H42).
- Definición de punto de fusión. Es la temperatura a la cual una sustancia cambia de estado sólido a estado líquido.
- Factores que influyen en el punto de fusión de los hidrocarburos (número de carbonos, simetría). El punto de fusión aumenta con el número de carbonos debido a mayores fuerzas de dispersión de London. La simetría molecular también es importante: moléculas más simétricas pueden empaquetarse mejor en el estado sólido, lo que resulta en puntos de fusión más altos.
- Ejemplo de cómo el número de carbonos afecta el punto de fusión. El hexano (C6H14) tiene un PF de -95.3°C, mientras que el decano (C10H22) tiene un PF de -29.7°C. A mayor número de carbonos, mayor PF.
- Definición de punto de ebullición. Es la temperatura a la cual una sustancia cambia de estado líquido a estado gaseoso (vapor).
- Fuerzas intermoleculares predominantes que afectan el punto de ebullición de los hidrocarburos. Las fuerzas de dispersión de London (también conocidas como fuerzas de van der Waals) son las fuerzas intermoleculares predominantes en los hidrocarburos.
- Relación entre el tamaño molecular, la superficie de contacto y el punto de ebullición. A medida que el tamaño molecular y la superficie de contacto entre las moléculas aumentan, las fuerzas de dispersión de London se hacen más fuertes, requiriendo más energía para superar estas atracciones y, por lo tanto, resultando en un punto de ebullición más alto.
- Ejemplo de cómo el número de carbonos afecta el punto de ebullición. El butano (C4H10) tiene un PE de -0.5°C, mientras que el octano (C8H18) tiene un PE de 125.7°C. El PE aumenta con el número de carbonos.
- Definición de densidad. Es la cantidad de masa por unidad de volumen de una sustancia (masa/volumen).
- Tendencia de la densidad con el aumento del número de carbonos en los hidrocarburos. La densidad de los hidrocarburos generalmente aumenta con el incremento del número de carbonos, ya que la masa molecular se incrementa más rápidamente que el volumen ocupado.
- Comparación de la densidad de los hidrocarburos con la del agua. La mayoría de los hidrocarburos son menos densos que el agua (~1 g/mL), por lo que flotan sobre ella.
- Ejemplo. El hexano tiene una densidad de aproximadamente 0.66 g/mL, mientras que el decano tiene una densidad de aproximadamente 0.73 g/mL. Ambos flotan en agua.
- Regla general de solubilidad ("lo semejante disuelve a lo semejante"). Esta regla establece que las sustancias polares se disuelven mejor en disolventes polares, y las sustancias no polares se disuelven mejor en disolventes no polares.
- Polaridad de los hidrocarburos y la razón de esta polaridad. Los hidrocarburos son compuestos no polares o de muy baja polaridad. Esto se debe a que los enlaces C-C son no polares y los enlaces C-H tienen una polaridad muy baja, y las moléculas tienen una distribución de carga uniforme.
- Solubilidad de los hidrocarburos en agua y disolventes no polares. Los hidrocarburos son generalmente insolubles en agua (un disolvente polar) pero son solubles en disolventes no polares (como benceno, éter, o tetracloruro de carbono).
- Ejemplos prácticos de solubilidad. El aceite (una mezcla de hidrocarburos) no se mezcla con el agua, pero se disuelve fácilmente en gasolina (una mezcla de hidrocarburos).
📊 Sección 3: Datos Experimentales y Comparaciones
- Importancia de obtener datos precisos de bases de datos confiables (ej. PubChem). Es fundamental para la investigación científica y las aplicaciones prácticas, ya que los valores experimentales pueden variar ligeramente entre fuentes y los datos aproximados no son suficientes para trabajos de precisión. Bases de datos como PubChem ofrecen información verificada y detallada.
- Ejemplos de datos reales para etano, eteno, etino, butano, 1-butino y 2-butino.
Compuesto Fórmula Estado (25°C) PF (°C) PE (°C) Densidad (g/mL) Etano C2H6 Gas -182.8 -88.6 0.546 (líq.) Eteno C2H4 Gas -169.2 -103.7 0.566 (líq.) Etino (Acetileno) C2H2 Gas -80.8 -84.0 (sublima) 0.620 (líq.) Butano C4H10 Gas -138.4 -0.5 0.573 (líq.) 1-Butino C4H6 Gas -125.7 8.1 0.650 (líq.) 2-Butino C4H6 Líquido -32.2 27.0 0.694 (líq.)
- ¿Cómo afecta la posición del triple enlace (terminal vs. interno) las propiedades físicas de los alquinos?
- Alquinos terminales (ej. 1-butino) tienen un hidrógeno ácido en el carbono del triple enlace, lo que les permite formar enlaces de hidrógeno débiles con otras moléculas polares (aunque no entre sí de forma significativa, pero sí con disolventes polares). También son ligeramente más polares debido a la asimetría.
- Alquinos internos (ej. 2-butino) son más simétricos y no tienen un hidrógeno ácido. Generalmente tienen puntos de ebullición y fusión ligeramente más altos que sus isómeros terminales debido a una mayor simetría que permite un mejor empaquetamiento y/o una mayor superficie de contacto para las fuerzas de London, y una polaridad nula o muy baja.
- Mencione el impacto en la simetría molecular, polaridad y fuerzas intermoleculares. Los alquinos internos suelen ser más simétricos, lo que puede aumentar su punto de fusión. La polaridad de los alquinos terminales es ligeramente mayor que la de los internos debido a la diferencia de electronegatividad entre el carbono sp y el hidrógeno. Las fuerzas intermoleculares predominantes siguen siendo las de dispersión de London, pero la simetría y la ligera polaridad pueden causar pequeñas variaciones.
- Revise los valores aproximados y las tendencias observadas para el etano, eteno y etino en cuanto a:
- Estado natural (a 25°C): Los tres son gases a temperatura ambiente.
- Punto de Fusión: Etano (-182.8°C), Eteno (-169.2°C), Etino (-80.8°C). El etino tiene el PF más alto, lo que puede atribuirse a su linealidad y la capacidad de empaquetarse de manera más eficiente en el estado sólido.
- Punto de Ebullición: Etano (-88.6°C), Eteno (-103.7°C), Etino (-84.0°C, sublima). Las diferencias son sutiles y dependen de la forma molecular y la eficiencia de las fuerzas de London. El etino, a pesar de ser más pequeño, tiene un PE ligeramente más alto que el etano debido a su forma lineal que permite un mayor contacto intermolecular.
- Densidad: Etano (0.546 g/mL), Eteno (0.566 g/mL), Etino (0.620 g/mL). La densidad tiende a aumentar con el grado de insaturación para el mismo número de carbonos, ya que la masa molecular es similar pero la estructura más compacta del alquino puede llevar a un volumen ligeramente menor.
- Observe las diferencias y similitudes entre estas clases de hidrocarburos con el mismo número de carbonos (cuando sea aplicable, como en el caso de C2).
Para C2:
- Similitudes: Todos son gases a temperatura ambiente. Las fuerzas de dispersión de London son las fuerzas intermoleculares predominantes en los tres.
- Diferencias: La hibridación de los carbonos cambia (sp3 en etano, sp2 en eteno, sp en etino), lo que afecta la geometría molecular (tetraédrica, trigonal plana, lineal) y las longitudes de enlace. Estas diferencias estructurales influyen en sus puntos de fusión y ebullición, aunque las tendencias no son siempre lineales debido a la complejidad de las interacciones moleculares.
❓ Cuestionario de Preguntas Cortas
Responda cada pregunta con 2-3 oraciones y luego haga clic en "Mostrar respuesta" para verificar.
Respuesta: Un alquino es un hidrocarburo que contiene al menos un triple enlace carbono-carbono en su molécula. Esta característica distintiva es la presencia de dicho triple enlace, que le confiere propiedades únicas.
Respuesta: Los carbonos del triple enlace en un alquino presentan hibridación sp. Los orbitales sp son más pequeños y compactos que los orbitales sp2 de los alquenos y los sp3 de los alcanos, lo que influye en la longitud y fuerza de los enlaces que forman.
Respuesta: La longitud del enlace carbono-carbono disminuye progresivamente de etano (enlace sencillo, ≈ 1.54 Å) a etileno (doble enlace, ≈ 1.34 Å) y a etino (triple enlace, ≈ 1.20 Å). Esto se debe al mayor solapamiento de los orbitales híbridos más pequeños (sp y sp2) y al incremento en el número de enlaces (uno sigma y dos pi en el triple enlace).
Respuesta: Un hidrocarburo con 15 carbonos (C15) se esperaría que sea un líquido a temperatura ambiente. Esto se debe a que los hidrocarburos con un número intermedio de carbonos (aproximadamente de 5 a 17) suelen presentarse en estado líquido, ya que sus fuerzas intermoleculares son lo suficientemente fuertes para mantenerlos unidos, pero no tanto como para formar un sólido.
Respuesta: El punto de ebullición es la temperatura a la cual una sustancia cambia de estado líquido a gaseoso, indicando la energía necesaria para que las moléculas escapen de la fase líquida. Depende principalmente de las fuerzas de dispersión de London (o fuerzas de van der Waals), que aumentan con el tamaño molecular y la superficie de contacto.
Respuesta: Los hidrocarburos son insolubles en agua porque son compuestos no polares o de muy baja polaridad, mientras que el agua es un disolvente polar. La regla general de solubilidad, "lo semejante disuelve a lo semejante", establece que las sustancias no polares se disuelven mejor en disolventes no polares, y no en polares como el agua.
Respuesta: Una mayor simetría molecular permite un mejor empaquetamiento de las moléculas en la estructura cristalina sólida. Esto resulta en fuerzas intermoleculares más eficientes y, en consecuencia, una mayor energía requerida para romper esa estructura, lo que se traduce en un punto de fusión más alto.
Respuesta: El compuesto B (alcano de 10 carbonos) esperaría que tenga una mayor densidad que el compuesto A (alcano de 6 carbonos). Esto se debe a que la densidad de los hidrocarburos generalmente aumenta con el número de carbonos, ya que la masa molecular se incrementa más rápidamente que el volumen ocupado por las moléculas.
9. ¿Cuál es la forma de la molécula de acetileno y cuáles son los ángulos de enlace característicos?
Respuesta: La molécula de acetileno es lineal. Presenta ángulos de enlace de 180° alrededor de los carbonos del triple enlace, lo que le confiere su característica forma recta.
Respuesta: Se recomienda consultar bases de datos fiables como PubChem porque los valores aproximados solo sirven para fines educativos y generales. Las bases de datos confiables proporcionan datos experimentales precisos y verificados para miles de compuestos, garantizando la mayor exactitud posible para aplicaciones reales, investigación y desarrollo.
✍️ Preguntas en Formato de Ensayo
Guía para responder:
- Estructura y Hibridación: Describa el etano (sp3, tetraédrico, enlace sencillo), etileno (sp2, trigonal plana, doble enlace) y etino (sp, lineal, triple enlace).
- Longitudes de Enlace: Compare las longitudes C-C y C-H para cada uno, explicando la tendencia decreciente con el aumento de la insaturación debido al **carácter s** de los orbitales híbridos.
- Propiedades Físicas:
- Punto de Ebullición: Todos son gases, pero el etino tiene un PE ligeramente más alto que el etano y etileno. Explique cómo la forma lineal del etino permite un mayor contacto intermolecular y, por ende, fuerzas de London más efectivas, a pesar de su menor tamaño.
- Densidad: La densidad aumenta ligeramente del etano al etino. Relacione esto con la masa molecular y el volumen ocupado por la molécula, donde la estructura más compacta del etino puede llevar a una mayor densidad.
- Fuerzas Intermoleculares: Enfatice que las fuerzas de dispersión de London son las predominantes en todos, pero su intensidad varía con la forma y el tamaño de la molécula.
Guía para responder:
- Regla de Solubilidad: Defina "lo semejante disuelve a lo semejante" como la tendencia de las sustancias con polaridades similares a formar soluciones.
- Polaridad de Hidrocarburos: Explique que los enlaces C-C son esencialmente no polares y los enlaces C-H tienen una polaridad muy baja debido a la pequeña diferencia de electronegatividad. Esto hace que las moléculas de hidrocarburos sean, en su conjunto, no polares.
- Insolubilidad en Agua: El agua es un disolvente altamente polar debido a sus enlaces O-H polares y su geometría angular que crea un dipolo neto. Los hidrocarburos no pueden formar interacciones significativas (como enlaces de hidrógeno) con las moléculas de agua, y el agua prefiere interactuar consigo misma, excluyendo a las moléculas no polares.
- Solubilidad en Disolventes No Polares: Los hidrocarburos son solubles en disolventes no polares (ej. benceno, hexano) porque ambos tipos de moléculas son no polares y pueden formar fuerzas de dispersión de London entre sí, lo que permite la mezcla.
Guía para responder:
- Concepto Clave: A medida que el número de carbonos aumenta, el tamaño molecular y la superficie de contacto aumentan, lo que lleva a un incremento en la intensidad de las fuerzas de dispersión de London.
- Estado Natural:
- 1-4 C: Gases (ej. Metano, Butano).
- 5-17 C: Líquidos (ej. Pentano, Octano).
- ≥ 18 C: Sólidos (ej. Parafina).
- Punto de Fusión (PF): Aumenta con el número de carbonos (ej. Hexano vs. Decano). Explique que se necesita más energía para romper las fuerzas intermoleculares en el sólido.
- Punto de Ebullición (PE): Aumenta con el número de carbonos (ej. Butano vs. Octano). Explique que se necesita más energía para que las moléculas escapen a la fase gaseosa.
- Densidad: Aumenta con el número de carbonos (ej. Hexano vs. Decano). Explique que la masa aumenta más rápidamente que el volumen.
- Ejemplos: Utilice los ejemplos proporcionados en la sección de "Propiedades Físicas" para ilustrar cada tendencia.
Guía para responder:
- Hibridación sp: Describa la formación de dos orbitales sp y dos orbitales p no hibridados en los carbonos del triple enlace.
- Geometría y Longitudes de Enlace: Explique cómo la hibridación sp resulta en una geometría lineal (180°) y enlaces C-C y C-H más cortos y fuertes debido al mayor **carácter s** de los orbitales.
- Acidez de Alquinos Terminales:
- El **carácter s** de los orbitales sp (50% carácter s, lo que significa que el orbital híbrido tiene una mayor contribución del orbital atómico s) hace que los electrones en el enlace C-H estén más cerca del núcleo de carbono, estabilizando la carga negativa de un anión acetiluro (R-C ≡ C-) si el hidrógeno se disocia como H+.
- Compare con alcanos (sp3, 25% carácter s) y alquenos (sp2, 33% carácter s), que son significativamente menos ácidos.
- Concluya que esta mayor acidez permite a los alquinos terminales reaccionar con bases fuertes para formar aniones acetiluro, que son nucleófilos importantes en síntesis orgánica.
Guía para responder:
- Simetría Molecular:
- 2-Butino (interno): Es más simétrico que el 1-butino. Esta mayor simetría permite un empaquetamiento más eficiente en el estado sólido, lo que generalmente conduce a un punto de fusión más alto. (PF 2-butino: -32.2°C vs. 1-butino: -125.7°C).
- 1-Butino (terminal): Menos simétrico, lo que dificulta un empaquetamiento ordenado en el sólido, resultando en un PF más bajo.
- Posición del Triple Enlace y Polaridad:
- 1-Butino: Tiene un hidrógeno terminal en el triple enlace, lo que le confiere una ligera polaridad (el carbono sp es ligeramente más electronegativo que el H). Esto puede influir en interacciones dipolo-dipolo débiles o enlaces de hidrógeno con disolventes polares.
- 2-Butino: Es un alquino interno y es una molécula no polar debido a su simetría, lo que significa que sus fuerzas intermoleculares son casi exclusivamente de dispersión de London.
- Puntos de Ebullición:
- 2-Butino (PE: 27.0°C): Tiene un PE más alto que el 1-butino (PE: 8.1°C). Aunque el 1-butino tiene una ligera polaridad, la mayor simetría y la superficie de contacto ligeramente diferente del 2-butino pueden contribuir a fuerzas de London más fuertes o más eficientes, o simplemente a una mayor masa molecular efectiva en el punto de ebullición.
- Conclusión: La posición del triple enlace y la simetría resultante tienen un impacto notable en las propiedades físicas, especialmente el punto de fusión, debido a cómo las moléculas pueden interactuar y empaquetarse en el estado condensado.