Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
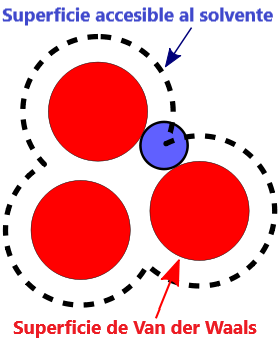
- Superficie VDW, la superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Propiedas Químicas

Escuchar Podcast
Haz clic en el botón para cargar y reproducir el audio.
Adición de Reactivos Simétricos
Adición de Hidrógeno
Considerando la relación entre reactivos y productos, el mejor ejemplo de las reacciones de adición es la hidrogenación de alquenos para producir alcanos.

La hidrogenación es la adición de H2 a un doble enlace. Un ejemplo es la adición de hidrógeno al doble enlace del etileno.
La adición no catalizada de hidrógeno a un alqueno, a pesar de ser exotérmica, es muy lenta. Sin embargo, la velocidad de la hidrogenación aumenta drásticamente con la presencia de ciertos catalizadores metálicos finamente divididos. El platino es el catalizador para la hidrogenación que se usa más frecuentemente, a pesar de que el paladio, níquel y rodio son también eficaces. La adición catalizada por un metal es normalmente rápida a temperatura ambiente, y el alcano se obtiene con un alto rendimiento y normalmente como único producto.

El disolvente usado en la hidrogenación catalítica se elige por su capacidad para disolver el alqueno y suele ser etanol, hexano o ácido acético. Los catalizadores metálicos son insolubles en estos disolventes (mejor dicho, en cualquier disolvente). Están presentes dos fases, la disolución y el metal, y la reacción tiene lugar en la interfase entre ellas. Las reacciones que implican a una sustancia en una fase con otra distinta en una segunda fase se definen como reacciones heterogéneas.
Adición de Halógenos
Los halógenos reaccionan normalmente con los alquenos mediante un mecanismo de adición electrofílica. .
Muchos de los rasgos que caracterizan al mecanismo generalmente aceptado para la adición de halógenos a los alquenos pueden presentarse tomando como referencia la reacción del etileno con el bromo.
En química orgánica se usan flechas curvas para indicar el movimiento de un par de electrones en un mecanismo de reacción. Se entiende que el par de electrones se mueve de la cola de la flecha (una fuente de electrones) a la cabeza (un átomo deficiente en electrones).

¡Atención!
Simulador del mecanismo de reacción de adición de bromo a un doble enlace.Adición de Reactivos Asimétricos
Adición de Haluros de Hidrógeno
En muchas reacciones de adición, el reactivo atacante, a diferencia de H2, es una molécula polar o fácilmente polarizable. Los haluros de hidrógeno, que están polarizados, se encuentran entre los ejemplos más sencillos de sustancias polares que se adicionan a los alquenos.

Molécula polar

La adición ocurre rápidamente en una gran variedad de disolventes, incluidos pentano, benceno, diclorometano, cloroformo y ácido acético.
La reactividad de los haluros de hidrógeno refleja su capacidad de donar un protón. El yoduro de hidrógeno es el ácido más fuerte entre los haluros de hidrógeno y reacciona con los alquenos a la velocidad más rápida.

Regla de Markovnikov
En el caso de una reacción entre un alqueno y un reactivo asimétrico, puede predecirse la formación de dos posibles productos. Por ejemplo, en la adición de bromuro de hidrógeno al propeno podría esperarse la formación tanto del 1-bromopropano como del 2-bromopropano. En realidad, cuando esta reacción se realiza en el laboratorio, sólo se forma un producto, y ese producto es el 2-bromopropano.

Este fenómeno se observó en todas las reacciones entre estos reactivos y alquenos asimétricos. En 1871, un químico ruso, Vladimir Markovnikov, sugirió una generalización que permite predecir el resultado de dicha reacción. Esta generalización empírica se conoce como regla de Markovnikov.

Mecanismo de la Reacción de Adición de Bromuro de Hidrógeno al Doble Enlace

¡Atención!
Simulador del mecanismo de reacción de adición de bromuro de hidrógeno a un doble enlace.Mecanismo de la Reacción de Adición de Bromuro de Hidrógeno al Doble Enlace siguiendo la regla de Markovnikov

¡Atención!
Simulador del mecanismo de reacción de adición de bromuro de hidrógeno a un doble enlace siguiendo la regla de Markovnikov.Hidratación
Los alquenos reaccionan con agua con un catalizador que es un ácido fuerte como el H2SO4. La reacción se utiliza para preparar alcoholes. En la ecuación general, el catalizador ácido se representa como H+.


Cuando se agrega agua a un enlace doble en el que los átomos de carbono están unidos a diferente número de átomos de H, el enlace doble no es simétrico. La regla de Markovnikov también se aplica cuando se agrega HOH a un alqueno no simétrico. Entonces la adición de agua sigue la regla de Markovnikov: el H de HOH se une al carbono del enlace doble que tiene mayor número de átomos de H, y el OH se une al carbono con menos átomos de H.


Regla de Markovnikov Interactiva
Cuando un ácido prótico (como HCl o HBr) se adiciona a un alqueno asimétrico, el átomo de hidrógeno del ácido se une al carbono del doble enlace que ya tiene más átomos de hidrógeno (el **carbono más hidrogenado**), y el átomo de halógeno se une al carbono del doble enlace que tiene menos átomos de hidrógeno (más sustituido).
¡Selecciona un alqueno y un haluro de hidrógeno para ver la aplicación!
Selecciona Reactivos
Guía de Estudio
📚 Guía de Estudio: Reacciones de Adición a Alquenos 📚
Esta guía de estudio está diseñada para revisar su comprensión de los diferentes tipos de reacciones de adición que experimentan los alquenos, incluyendo reactivos simétricos y asimétricos, y conceptos clave como la Regla de Markovnikov.
✨ Visión General
Resumen del Tema
Este estudio se enfoca en las reacciones de adición a alquenos, procesos fundamentales en química orgánica donde los átomos o grupos se añaden a través del doble enlace carbono-carbono.
Exploraremos los tipos de reactivos, los mecanismos involucrados y las reglas que predicen los productos, como la importante Regla de Markovnikov.
I. Tipos de Reacciones de Adición
Hidrogenación:
- Definición: Adición de H2 a un doble enlace para producir alcanos.
- Ejemplo: Adición de H2 a etileno.
- Velocidad de reacción: Lenta sin catalizador, drásticamente aumentada con catalizadores metálicos.
- Catalizadores comunes: Platino (más frecuente), paladio, níquel, rodio.
- Condiciones: Rápida a temperatura ambiente, alto rendimiento.
- Disolventes: Etanol, hexano, ácido acético (disuelven el alqueno).
- Naturaleza de la reacción: Reacción heterogénea (interfase entre solución y metal).
Adición de Halógenos:
- Mecanismo: Adición electrofílica.
- Ejemplo: Reacción de etileno con bromo.
- Representación: Flechas curvas para indicar movimiento de electrones.
Adición de Haluros de Hidrógeno:
- Reactivos: Moléculas polares o fácilmente polarizables (ej. HCl, HBr, HI).
- Disolventes: Pentano, benceno, diclorometano, cloroformo, ácido acético.
- Reactividad: Refleja la capacidad de donar un protón (HI es el más reactivo).
Regla de Markovnikov:
- Contexto: Reacción entre un alqueno y un reactivo asimétrico.
- Predicción: Sólo se forma un producto principal.
- Enunciado (generalización empírica): En la adición de HX a un alqueno asimétrico, el átomo de hidrógeno se adiciona al carbono del doble enlace que ya tiene más átomos de hidrógeno, y el halógeno se adiciona al carbono con menos hidrógenos.
- Mecanismo: Importancia de la estabilidad del carbocatión intermedio.
Hidratación:
- Reactivos: Alquenos con agua y un catalizador ácido fuerte (ej. H2SO4).
- Producto: Alcoholes.
- Aplicación de la Regla de Markovnikov: Si el alqueno es asimétrico, el H de HOH se une al carbono del doble enlace con más átomos de H, y el OH se une al carbono con menos átomos de H.
II. Conceptos Clave
Reactivos Asimétricos: Aquellos donde los átomos o grupos que se adicionan son diferentes (ej. HCl, HBr, H2O).
❓ Quiz: Reacciones de Adición a Alquenos
Instrucciones: Responda cada pregunta en 2-3 oraciones.
✍️ Preguntas de Formato Ensayo
Guía para responder: Discute que la hidrogenación usa H2 y catalizador metálico (reacción heterogénea, no Markovnikov), produciendo alcanos. La adición de HX usa haluros de hidrógeno (reactivos polares, adición electrofílica, sigue Markovnikov), produciendo haloalcanos. Compara la necesidad de catalizadores y la regioselectividad.
Guía para responder: Explica que los catalizadores metálicos (ej. Pt, Pd) adsorben el H2 y el alqueno en su superficie, debilitando los enlaces y facilitando la adición. Es heterogénea porque el catalizador es sólido y los reactivos están en fase líquida/gaseosa, lo que significa que la reacción ocurre en la superficie del metal, afectando la velocidad y selectividad.
Guía para responder: Define la regla de Markovnikov (H al carbono con más H). Explica que su origen radica en la formación del carbocatión más estable como intermedio (terciario > secundario > primario). Aplícala a la adición de HBr a propeno (formando 2-bromopropano) y a la hidratación de propeno (formando 2-propanol).
Guía para responder: Describe cómo el doble enlace (nucleófilo) ataca al Br2 (electrófilo), formando un ion bromonio cíclico y un ion bromuro. Luego, el bromuro ataca al ion bromonio. Enfatiza cómo las flechas curvas muestran el flujo de electrones en cada paso, desde una fuente de electrones a un sumidero de electrones, crucial para entender la ruptura y formación de enlaces.
Guía para responder: Explica que la regla de Markovnikov se aplica a reactivos asimétricos y polares (o polarizables) como HX (HCl, HBr, HI) y H2O. La polaridad permite que el reactivo se divida en una parte electrófila (generalmente H+) y una nucleófila, guiando la adición según la estabilidad del carbocatión intermedio. Menciona que reactivos simétricos (H2, Br2) no siguen Markovnikov.