Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
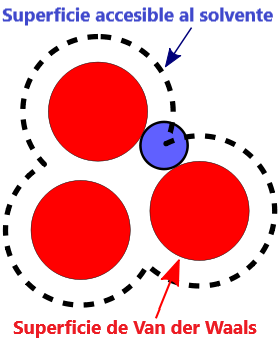
- Superficie VDW, la superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Isómeros

Escuchar Podcast
Haz clic en el botón para cargar y reproducir el audio.
Isómeros cis-trans
Mientras que el etileno es el único alqueno con dos átomos de carbono y el propeno es el único con tres, existen cuatro alquenos isómeros de fórmula molecular C4H8 :1-buteno, 2-metilpropeno, cis-2-buteno, trans-2-buteno.
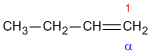
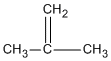
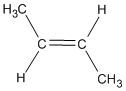
El 1-buteno tiene una cadena carbonada sin ramificar con un doble enlace entre C-1 y C-2. Es un isómero constitucional de los otros tres. De forma similar, el isobutileno, con una cadena ramificada, es un isómero constitucional de los otros tres.
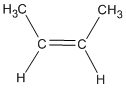
El par de isómeros designados como cis-2-buteno y trans-2-buteno tienen la misma constitución; ambos tienen una cadena no ramificada con un doble enlace que conecta C-2 con C-3. Pero uno se diferencia del otro en que el isómero cis tiene los dos grupos metilo del mismo lado del doble enlace, mientras que en el isómero trans están opuestos del doble enlace. Recordemos que los isómeros que tienen la misma constitución pero se diferencian en la disposición diferente de los átomos en el espacio se denominan estereoisómeros. El cis-2-buteno y el trans-2-buteno son estereoisómeros y los términos cis y trans especifican la configuración del doble enlace.
Los orbitales p que forman el enlace π deben estar dispuestos paralelamente para que el traslape sea mayor. Por lo tanto, no es posible la rotación cuando hay un doble enlace. Si hubiera rotación, esta haría que el enlace Π se rompiera.
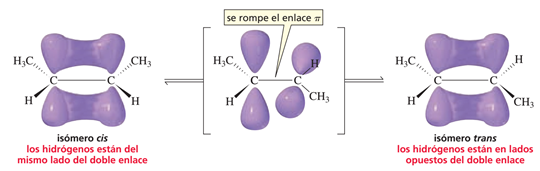
Por lo anterior se da la posibilidad de dos isómeros completamente distintos espacialmente, si los hidrógenos quedan del mismo lado se forma el isómero cis y si quedan en lados opuestos del doble enlace se forma el isómero trans. También se les conoce con el nombre de isómeros geométricos.
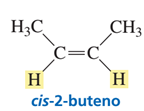
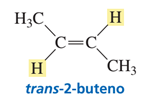
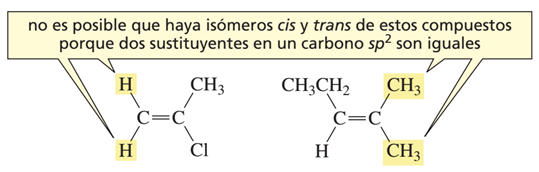
Si se diera el caso en el que uno de los dos átomos de carbono estuviera unido a dos grupos sustituyentes idénticos sólo habría una estructura posible para dicho compuesto. Por lo tanto, en estos casos, no es posible la isomería cis-trans.
Debido a la diferente distribución espacial de los átomos en torno del doble enlace en los isómeros cis-trans, estos son compuestos distintos y con propiedades físicas diferentes. Tal es el caso del cis-2-buteno que tiene un punto de ebullición de 3.7 °C en comparación con el trans-2-buteno que tiene un punto de ebullición de 0.9 °C.
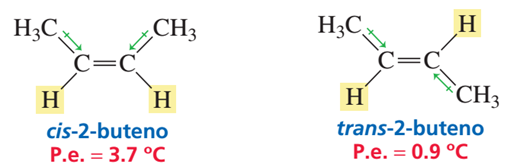
El menor punto de ebullición del , aunque sea poca la diferencia, en relación al se debe esencialmente a que su molécula tiende más a la forma esférica (más simétrica), lo que le permite absorber una mayor cantidad de energía, descendiendo su punto de ebullición.
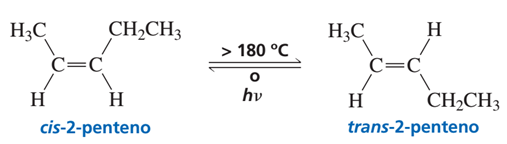
Se da la posibilidad que el isómero cis se convierta en el isómero trans por absorción de enegía como calor o luz ultravioleta, tal como se muestra a continuación en el cis-2-penteno.
Guía de Estudio
📚 Guía de Estudio: Isómeros Cis-Trans 📚
Este estudio se enfoca en los isómeros cis-trans, un tipo de estereoisómeros que se encuentran en alquenos, específicamente aquellos con un doble enlace carbono-carbono que impide la rotación libre. Se examina cómo la disposición espacial de los grupos sustituyentes alrededor del doble enlace da origen a estas dos configuraciones distintas (cis y trans) y cómo esta diferencia estructural afecta sus propiedades físicas. También se discute la imposibilidad de la isomería cis-trans cuando uno de los carbonos del doble enlace está unido a dos grupos idénticos y la interconversión de isómeros por absorción de energía.
❓ Preguntas de Repaso (Respuesta Corta)
✍️ Preguntas de Ensayo
Guía para responder: Explica que la rotación restringida es fundamental para "fijar" los grupos en el espacio, creando isómeros estables. Si la rotación fuera libre, las configuraciones cis y trans se interconvertirían rápidamente y no serían isómeros distinguibles, sino conformaciones de la misma molécula.
Guía para responder: Compara puntos de ebullición (cis > trans), puntos de fusión (trans > cis), y polaridad (cis más polar si los grupos son dipolares). Explica que las diferencias se deben a la simetría molecular y cómo afecta las fuerzas intermoleculares de Van der Waals y los momentos dipolares netos.
Guía para responder: Explica que la energía (calor, luz UV) rompe el enlace π, permitiendo la rotación alrededor del enlace σ y la subsiguiente reformación del enlace π en la nueva configuración. Discute cómo esto implica una barrera de energía y puede afectar la estabilidad termodinámica y la reactividad en ciertas reacciones (ej. polimerización).
Guía para responder: Define isómeros constitucionales como aquellos con diferente conectividad (ej. 1-buteno y 2-metilpropeno). Define estereoisómeros como aquellos con la misma conectividad pero diferente disposición espacial (ej. cis-2-buteno y trans-2-buteno). Usa las estructuras para ilustrar claramente las diferencias.
Guía para responder: Explica la regla: si uno de los carbonos del doble enlace tiene dos grupos idénticos, no hay isomería cis-trans. Discute cómo esto simplifica la predicción de la geometría y es crucial para la síntesis, ya que solo se formará un producto en lugar de una mezcla de isómeros.