Instrucciones
Cargar archivo PDB
Diferentes formas de representación de las moléculas
- "Amino" es un esquema que asigna colores a los aminoácidos en función de sus propiedades químicas, p. ácido, básico, hidrofóbico o polar. Los colores son ASP, GLU, CYS, MET, LYS, ARG, SER, THR, PHE, TYR, ASN, GLN, GLY, LEU, VAL, ILE, ALA, TRP, HIS y PRO. Los ácidos nucleicos son de color caré claro en el esquema "amino".
- "Cadena" es un esquema que da un color diferente a cada cadena del archivo pdb.
- "Grupo" es un esquema que colorea las cadenas de proteínas de manera diferencial en la dirección amino-carboxi. Este esquema también colorea las cadenas de ácido nucleico de manera diferencial en la dirección 5 '> 3'.
- "Temperatura" es un esquema que colorea los átomos de acuerdo con sus temperaturas anisotrópicas, almacenadas como un valor beta en un archivo pdb. La temperatura anisotrópica indica la movilidad de un átomo o la incertidumbre de posición. Los segmentos más "móviles" y más cálidos son de color rojo, progresando a fragmentos azules más inmóviles.
- "Estructura" es un esquema de color muy útil porque colorea de manera diferencial la estructura secundaria de una proteína (hélices α y láminas β). Es mejor usar un comando de visualización que ilustre la estructura secundaria cuando se utiliza el esquema de colores de la estructura (por ejemplo, cintas, dibujos animados, esqueleto, trazas o hebras; consulte la sección Visualización).
Clasificación de los aminoácidos
- Ácidos: Asp, Glu
- No cíclicos
- Alifáticos: Ala, Gly, Ile, Leu, Val
- Aromáticos: His, Phe, Trp, Tyr
- Básicos: Arg, His, Lys
- Interiores: Ala, Leu, Val, Ile, Phe, Cys, Met, Trp
- Con carga: Asp, Glu, Arg, His, Lys
- Hidrofóbicos: Ala, Leu, Val, Ile, Pro, Phe, Met, Trp
- Polares: Cys, Gly, Ser, Thr, Lys, Asp, Asn, Glu, Arg, Gln, Tyr, His
- Pequeños: Ala, Gly, Ser
Metales
Grupos Prostéticos
Superficie y Cavidades
Sección
Estructura de Proteínas
Evolución.
Los mecanismos de la evolución molecular han dejado su huella en la secuencia y estructura de la globinas.
Atención!
La globina es una proteína de predominio globular (estructura terciaria) que forma parte de la hemoglobina (heteroproteína) siendo la globina la parte proteica. Existen varios tipos de cadenas de globina, que se designan mediante letras griegas (alfa, beta, gamma, etc.).
Cuando Charles Darwin desarrolló su teoría de la evolución, el funcionamiento interno de la célula era en gran parte un misterio. Su visión revolucionaria, de que las poblaciones de organismos evolucionan bajo la selección natural, se basaba principalmente en sus observaciones de plantas y animales que vivían a su alrededor. Los mecanismos internos de la evolución fueron descubiertos más tarde, con los detalles de la información genética, la herencia y la mutación. Hoy en día, tenemos una abundancia de datos para explorar, lo que nos permite ver y comprender la biología molecular subyacente detrás de la evolución.
Árbol de la vida
Desde que los biólogos comenzaron a mirar de cerca los seres vivos, era evidente que todo lo que vivía en la Tierra estaba relacionado. Algunos son parientes: los caballos comparten muchos rasgos con las vacas. Otros son parientes más lejanos: las estrellas de mar son muy diferentes de los elefantes. Al analizar cuidadosamente estas similitudes y diferencias, los biólogos construyeron un árbol de la vida, con organismos similares agrupados muy juntos en ramas individuales y organismos diferentes dispersos en ramas distantes. Hoy en día, el estudio de las secuencias genómicas de estos organismos nos permite hacer este árbol más cuantitativo. Si asumimos que las diferencias en las secuencias genómicas se acumulan a una tasa aproximadamente igual a medida que los organismos evolucionan, podemos usar estos datos para construir un árbol de vida filogenético.
Árbol filogenético´del Hombre
Evolución de las Globinas
Para construir este tipo de árbol, necesitamos tener una proteína que sea esencial en todos los organismos que estamos estudiando, de modo que todos ellos tengan un gen correspondiente en su genoma. El árbol mostrado aquí utiliza la proteína mioglobina, y se limita a los vertebrados. Como puede ver, nuestros parientes más cercanos, los mamíferos, tienen mioglobinas que son bastante similares, pero los reptiles y los peces han tenido más tiempo para divergir y sus mioglobinas tienen más cambios. Los árboles que abarcan una gama más amplia de organismos, desde bacterias a seres humanos, a menudo se construyen utilizando biomoléculas que son aún más esenciales, como la maquinaria central de síntesis de proteínas o metabolismo energético.
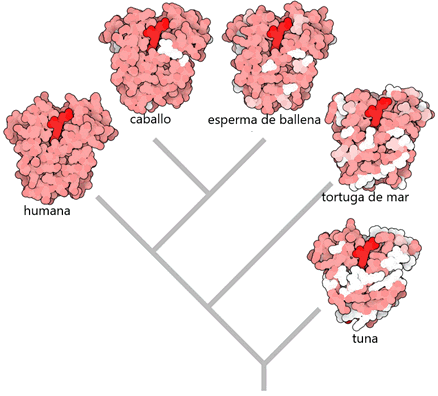
Árbol filogenético´del Hombre

Se comparan secuencias de mioglobina de cinco animales diferentes para crear un árbol filogenético. Cada molécula está coloreada para mostrar diferencias de la proteína humana. Aminoácidos que son idénticos son de color rosa, los aminoácidos que son diferentes, pero similares son más claros de color rosa, y los aminoácidos que son completamente diferentes están en blanco. El hemo se muestra en rojo brillante. El árbol fue calculado con el servidor en línea en phylogeny.fr. PDB entradas:
- , estructura cristalina de mioglobina humana mutante K45R
- , mioglobina del corazón de caballo
- , estructura cristalina de mioglobina de esperma de ballena
- , mioglobina de tortuga marina
- , mioglobina de salmón rojo
Comparaciones
Análisis Computacional
Observe que el grupo conincide casi al 100% en todos los modelos.
Atención!
Simulador de comparación entre mioglobina humana ( 3rgk: rojo) y mioglobina de caballo (1ymb: amarillo) : ...Hacer clic aquí.
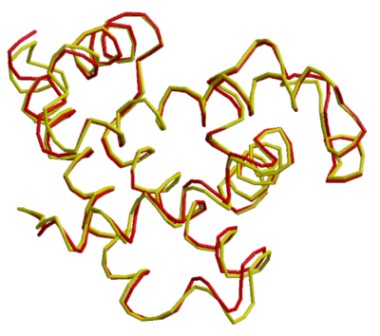
Atención!
Simulador de comparación entre mioglobina humana (3rgk: rojo) y mioglobina de esperma de ballena (1mbo: amarillo): ...Hacer clic aquí.
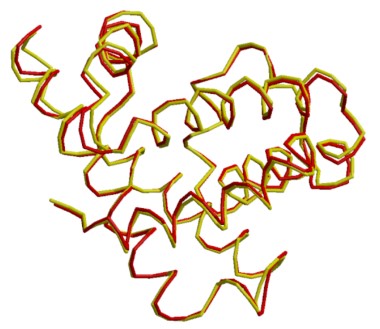
Atención!
Simulador de comparación entre mioglobina humana (3rgk: rojo) y mioglobina de tortuga de mar (1lhs: amarillo): ...Hacer clic aquí.
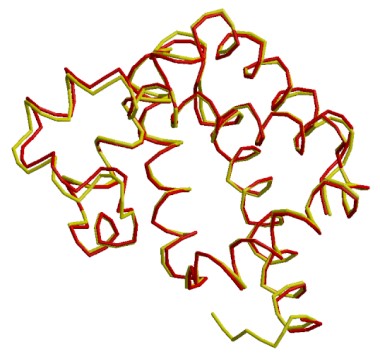
Atención!
Simulador de comparación entre mioglobina humana (3rgk: rojo) y mioglobina de salmón rojo (2nrl: amarillo): ...Hacer clic aquí.
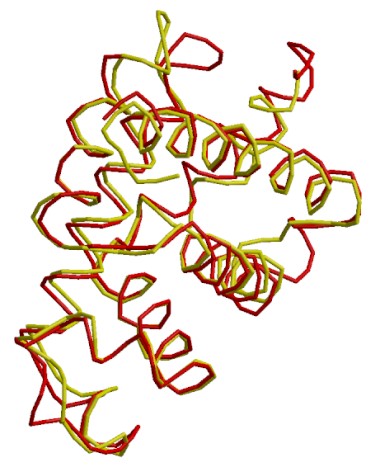
Mioglobina de Ballena
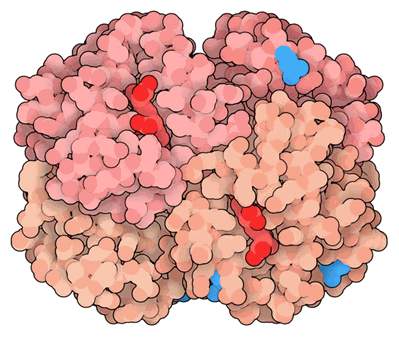
Las ballenas y los delfines tienen una gran necesidad de mioglobina, para que puedan almacenar oxígeno extra para su uso en sus profundas inmersiones submarinas. Típicamente, tienen unas 30 veces más que en animales que viven en tierra. Un estudio reciente reveló que algunas modificaciones especiales son necesarias para hacer esto posible. Comparando la mioglobina de las ballenas () con mioglobina de cerdo (), encontramos que hay varias mutaciones que agregan aminoácidos extra cargados positivamente a la superficie. Los animales marinos suelen tener estas cargos adicionales en la superficie de su mioglobina para ayudar a repeler las moléculas vecinas y evitar la agregación cuando la mioglobina está en altas concentraciones.
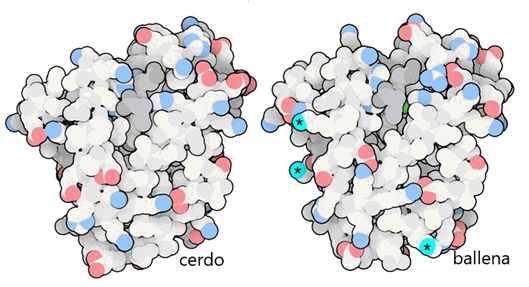
La mioglobina de las ballenas tiene cinco aminoácidos cargados positivamente más que la mioglobina del cerdo. Tres de los cinco se ven en esta vista, se muestra con estrellas. Los aminoácidos cargados positivamente están en azul y los negativamente cargados están en rojo
Oxígeno Unido a la Mioglobina
La estructura de la , muestra que el oxígeno se une al átomo de hierro dentro de la proteína. Entonces, ¿cómo entra y sale? La respuesta es que la estructura en el PDB es sólo una instantánea de la proteína, capturado cuando está en una forma cerrada. En realidad, la mioglobina (y todas las demás proteínas) está constantemente en movimiento, realizando pequeños movimientos de flexión y respiración. Así, las aberturas temporales constantemente aparecen y desaparecen, permitiendo que el oxígeno entre y salga.
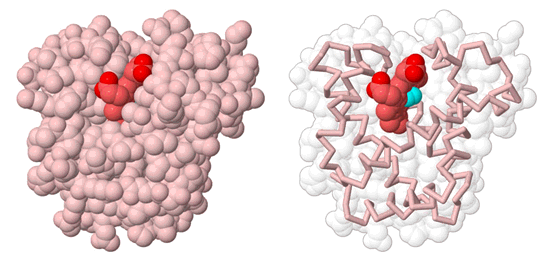
Mioglobina (rosa) con oxígeno (turquesa) ligado al hemo (rojo).
Aspectos Estructurales de la Mioglobina
La estructura atómica de la reveló muchos de los principios básicos de la estructura y estabilidad de las proteínas. Por ejemplo, la estructura mostró que cuando la cadena proteica se pliega en una estructura globular, los aminoácidos ricos en carbono se protegen en el interior y los aminoácidos cargados se encuentran más a menudo en la superficie, formando ocasionalmente puentes salinos que emparejan dos cargas opuestas (círculos verdes).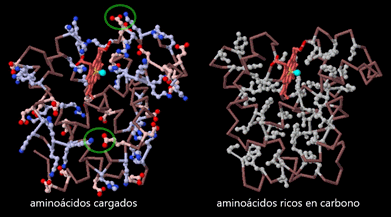
Mutación de las Globinas
La evolución darwiniana depende de la diversidad en una población, de modo que hay individuos con diferentes rasgos, algunos de los cuales podrían ser beneficiosos y serán seleccionados para un entorno particular. Esta diversidad se genera por la mutación del genoma, produciendo proteínas ligeramente alteradas con diferentes características funcionales. Muchos ejemplos de estos tipos de mutaciones, y sus consecuencias, se encuentran en los archivos PDB. Por ejemplo, la mioglobina en mamíferos acuáticos puede ser empaquetada más densamente que las mioglobinas típicas, lo que le permite almacenar oxígeno extra para sus inmersiones largas, y la mutación de sitio único en la hemoglobina de células falciformes humanas causa la enfermedad, pero también puede proporcionar protección contra la infección por el paludismo.
Mecanismos de la Evolución
Mirando de cerca las secuencias de genes y las estructuras de proteínas, también podemos desentrañar algunos de los mecanismos de la evolución. Por ejemplo, usted puede imaginar que es difícil para una proteína evolucionar, ya que necesita ser continuamente activa para mantener el organismo vivo. Buscando en el genoma, encontramos que este problema a menudo se resuelve a través de la duplicación de genes. Se hace una copia del gen, que es entonces libre de evolucionar sin comprometer el organismo. En las globinas, esto ha ocurrido varias veces en el pasado lejano. Hay un grupo de genes en nuestro genoma que codifican varias variantes de la cadena beta de hemoglobina. Por ejemplo, los genes gamma-2 y epsilon codifican variantes que cambian sutilmente las propiedades de la hemoglobina para las necesidades especializadas de fetos y embriones. Cambios más grandes se observan en otras globinas, evolucionado a partir de otros eventos de duplicación de genes, como la cadena alfa de la hemoglobina, la mioglobina y dos globinas recién descubiertas de función desconocida.
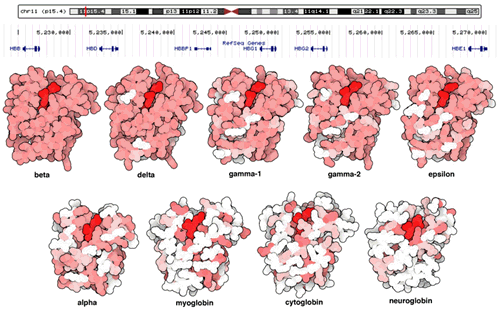
Todas las anteriores proteínas codificadas en el cromosoma 11 del genoma humano revelan que son bastante similares, con pequeñas mutaciones que sintonizan la función de sus tareas en la vida embrionaria, fetal y adulta. Las cuatro globinas en la parte inferior tienen diferentes funciones, como se refleja en sus secuencias muy diferentes. Las anteriores proteínas están coloreadas basándose en las diferencias con la cadena beta de la hemoglobina.
A continuación puede ver los modelos moleculares de estas proteínas:
Reconstrucción de Globinas Antiguas
En casos especiales, también podemos mirar atrás en la historia para estudiar la evolución de la vida. Usando el ADN aislado de un hueso de mamut encontrado congelado en Siberia, los investigadores reconstruyeron los genes de las cadenas alfa y beta de la hemoglobina de esta especie extinta y la utilizaron para sintetizar la proteína en las bacterias (). La hemoglobina gigantesca es muy similar a la hemoglobina de los elefantes modernos, pero al analizar la proteína mostró que los pequeños cambios hacen que funcione mejor a temperaturas frías. La secuencia también apoyó otros estudios que mostraron que los mamuts están más estrechamente relacionados con los elefantes asiáticos que con los elefantes africanos.
La estructura de la hemoglobina de mamut tiene cuatro cambios de aminoácidos (mostrados en azul) en comparación con los elefantes asiáticos modernos.
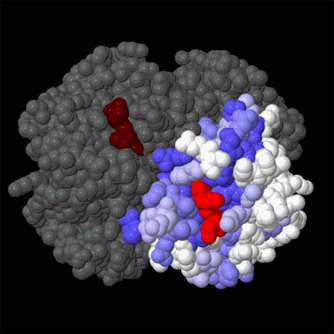
Conservación de Secuencias en la Cadena Beta de la Hemoglobina
Los biólogos moleculares a menudo miran la variación evolutiva en términos de "conservación". Las regiones de la proteína con funciones esenciales son muy similares cuando miramos diferentes organismos, mientras que las regiones que desempeñan un papel de soporte fundamental son bastante diferentes. La hemoglobina que se muestra a continuación () , con una cadena beta de color gris por conservación. Como puede ver, las regiones alrededor del grupo hemo también son conservadas pero las regiones exteriores en color blanco no lo son.