Instrucciones
Cargar archivo PDB
Diferentes formas de representación de las moléculas
- "Amino" es un esquema que asigna colores a los aminoácidos en función de sus propiedades químicas, p. ácido, básico, hidrofóbico o polar. Los colores son ASP, GLU, CYS, MET, LYS, ARG, SER, THR, PHE, TYR, ASN, GLN, GLY, LEU, VAL, ILE, ALA, TRP, HIS y PRO. Los ácidos nucleicos son de color caré claro en el esquema "amino".
- "Cadena" es un esquema que da un color diferente a cada cadena del archivo pdb.
- "Grupo" es un esquema que colorea las cadenas de proteínas de manera diferencial en la dirección amino-carboxi. Este esquema también colorea las cadenas de ácido nucleico de manera diferencial en la dirección 5 '> 3'.
- "Temperatura" es un esquema que colorea los átomos de acuerdo con sus temperaturas anisotrópicas, almacenadas como un valor beta en un archivo pdb. La temperatura anisotrópica indica la movilidad de un átomo o la incertidumbre de posición. Los segmentos más "móviles" y más cálidos son de color rojo, progresando a fragmentos azules más inmóviles.
- "Estructura" es un esquema de color muy útil porque colorea de manera diferencial la estructura secundaria de una proteína (hélices α y láminas β). Es mejor usar un comando de visualización que ilustre la estructura secundaria cuando se utiliza el esquema de colores de la estructura (por ejemplo, cintas, dibujos animados, esqueleto, trazas o hebras; consulte la sección Visualización).
Clasificación de los aminoácidos
- Ácidos: Asp, Glu
- No cíclicos
- Alifáticos: Ala, Gly, Ile, Leu, Val
- Aromáticos: His, Phe, Trp, Tyr
- Básicos: Arg, His, Lys
- Interiores: Ala, Leu, Val, Ile, Phe, Cys, Met, Trp
- Con carga: Asp, Glu, Arg, His, Lys
- Hidrofóbicos: Ala, Leu, Val, Ile, Pro, Phe, Met, Trp
- Polares: Cys, Gly, Ser, Thr, Lys, Asp, Asn, Glu, Arg, Gln, Tyr, His
- Pequeños: Ala, Gly, Ser
Metales
Grupos Prostéticos
Superficie y Cavidades
Sección
Estructura de Proteínas
Comparación entre Mioglobina y Hemoglobina
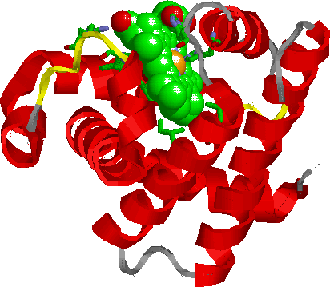
Mioglobina
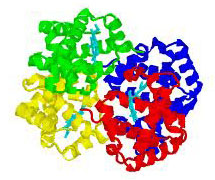
Hemoglobina
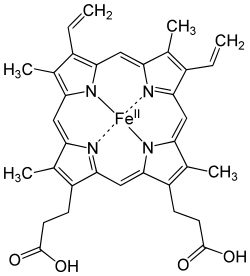
Grupo Hemo
Mioglobina
La es una hemoproteína (proteínas que contienen un grupo prostético hemo) muscular, estructuralmente y funcionalmente muy parecida a la hemoglobina, es una proteína relativamente pequeña constituida por una cadena polipeptídica de 153 residuos aminoacídicos que contiene un grupo hemo con un átomo de hierro, y cuya función es la de almacenar y transportar oxígeno. También se denomina miohemoglobina o hemoglobina muscular.
Las mayores concentraciones de mioglobina se encuentran en el músculo esquelético y en el músculo cardíaco, donde se requieren grandes cantidades de O2 para satisfacer la demanda energética de las contracciones.
La mioglobina fue la primera proteína a la que se determinó su estructura tridimensional por cristalografía de rayos X en 1957. Es una proteína extremadamente compacta y globular, en la que la mayoría de los aminoácidos hidrofóbicos se encuentran en el interior y muchos de los residuos polares expuestos en la superficie. Alrededor del 75% de la estructura secundaria tiene una conformación de α-hélice; de hecho, existen ocho segmentos de α-hélice en la mioglobina, designados de la A a la H.
Dentro de una cavidad hidrofóbica de la proteína se encuentra el grupo prostético hemo. Esta unidad no polipeptídica se encuentra unida de manera no covalente a la mioglobina y es esencial para la actividad biológica de unión de O2 de la proteína.
La mioglobina y el , forman parte de las proteínas hémicas, que intervienen en el transporte y fijación de oxígeno, el transporte de electrones y la fotosíntesis. Estas proteínas poseen como grupo prostético un Tetrapirrol cíclico o grupo Hem, o Hemo, formado por cuatro anillos de pirrol planares enlazados por puentes de alfa metileno. En el centro de este anillo existe un hierro ferroso (Fe+2). En el caso del citocromo la oxidación y reducción del átomo de hierro son esenciales para la actividad biológica. Para la mioglobina y la hemoglobina la oxidación del Fe+2 destruye su actividad biológica.
En la mioglobina no oxigenada, el hierro del Hem (grupo hemo) se encuentra aproximadamente a 0,03 nm fuera del plano del grupo en dirección a la HisF8. La oxigenación de la mioglobina produce el movimiento del átomo de hierro, ya que el oxigeno ocupa la sexta posición de coordinación del hierro y desplaza el residuo HisF8 0,01nm fuera del plano del Hemo.
Este movimiento en el anillo Hem produce el cambio conformacional de algunas regiones de la proteína, lo que favorece la liberación de oxígeno en las células deficientes de oxígeno, en donde éste se requiere para la generación de energía metabólica dependiente de ATP.
Hemoglobina
Las de todos los mamíferos tienen un peso molecular aproximado de 65.000 y en esencia son tetrámeros, que constan de 4 cadenas péptidas, cada una de las cuales esta unida a un grupo hemo. Las moléculas de hemoglobina se forman por combinación de dos subunidades de una cadena peptídica llamada α y dos de β donde las cadenas polipeptídicas están constituidas por eslabones de aminoácidos (AA) denominados residuos; conteniendo 141 residuos la cadena α y 146 la cadena β. Todo ser humano es capaz de sintetizar (genéticamente) e introducir en la hemoglobina cuatro cadenas polipéptidas designadas α , β , γ y δ. Con escasas excepciones las moléculas de HB se forman por la combinación de dos cadenas α con dos γ o δ.