Instrucciones
Cargar archivo PDB
Diferentes formas de representación de las moléculas
- "Amino" es un esquema que asigna colores a los aminoácidos en función de sus propiedades químicas, p. ácido, básico, hidrofóbico o polar. Los colores son ASP, GLU, CYS, MET, LYS, ARG, SER, THR, PHE, TYR, ASN, GLN, GLY, LEU, VAL, ILE, ALA, TRP, HIS y PRO. Los ácidos nucleicos son de color caré claro en el esquema "amino".
- "Cadena" es un esquema que da un color diferente a cada cadena del archivo pdb.
- "Grupo" es un esquema que colorea las cadenas de proteínas de manera diferencial en la dirección amino-carboxi. Este esquema también colorea las cadenas de ácido nucleico de manera diferencial en la dirección 5 '> 3'.
- "Temperatura" es un esquema que colorea los átomos de acuerdo con sus temperaturas anisotrópicas, almacenadas como un valor beta en un archivo pdb. La temperatura anisotrópica indica la movilidad de un átomo o la incertidumbre de posición. Los segmentos más "móviles" y más cálidos son de color rojo, progresando a fragmentos azules más inmóviles.
- "Estructura" es un esquema de color muy útil porque colorea de manera diferencial la estructura secundaria de una proteína (hélices α y láminas β). Es mejor usar un comando de visualización que ilustre la estructura secundaria cuando se utiliza el esquema de colores de la estructura (por ejemplo, cintas, dibujos animados, esqueleto, trazas o hebras; consulte la sección Visualización).
Clasificación de los aminoácidos
- Ácidos: Asp, Glu
- No cíclicos
- Alifáticos: Ala, Gly, Ile, Leu, Val
- Aromáticos: His, Phe, Trp, Tyr
- Básicos: Arg, His, Lys
- Interiores: Ala, Leu, Val, Ile, Phe, Cys, Met, Trp
- Con carga: Asp, Glu, Arg, His, Lys
- Hidrofóbicos: Ala, Leu, Val, Ile, Pro, Phe, Met, Trp
- Polares: Cys, Gly, Ser, Thr, Lys, Asp, Asn, Glu, Arg, Gln, Tyr, His
- Pequeños: Ala, Gly, Ser
Metales
Grupos Prostéticos
Superficie y Cavidades
Sección
Estructura de Proteínas
Criterios de Origen Evolutivo.
Se puede decir que una proteína está formadas por una o más cadenas polipeptídicas de más de 100 aminoácidos. La estructura primaria de las proteínas es la secuencia de aminoácidos, que está codificada por los genes correspondientes; de hecho, es eso precisamente todo lo que hacen los genes: codificar secuencia de aminoácidos de las proteínas que forman un organismo. En el genoma (conjunto de genes) están también las señales de control de la expresión de los genes, m´ss los genes de los RNA que participan en el proceso de síntesis de proteínas y las correspondientes señales de control. En contra de lo que se ha dicho hasta la saciedad, el genoma no es el “plano de un organismo”, en el sentido que se entiende normalmente por plano. El el almacén de la estructura primaria de las proteínas del organismo, de las moléculas encargadas de su expresión y de las señales de control de todo el proceso.
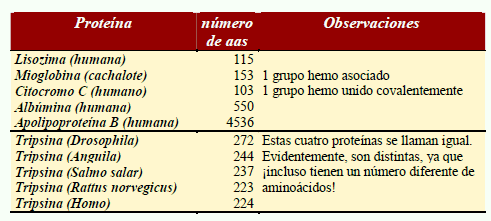
La longitud de las cadenas polipeptídicas constituyentes de las proteínas es muy variable. Algunos ejemplos se muestran a continuación; las cadenas de más de 1000 aminoácidos son raras; el caso de la apolipoproteína B es excepcional.
Cadena polipeptídica de apoB100 y dominios
La proteína más grande conocida es la (fragmento), que contiene más de 34,000 aminoácidos y actúa como una banda elástica en el músculo. La titina se especializa en la elasticidad. Su estiramiento ocurre en múltiples etapas.
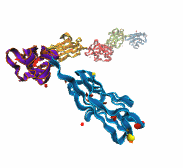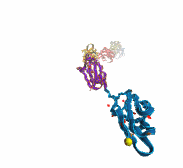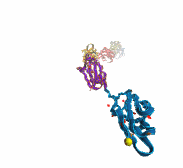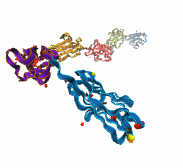
Titina, proteína elástica del músculo
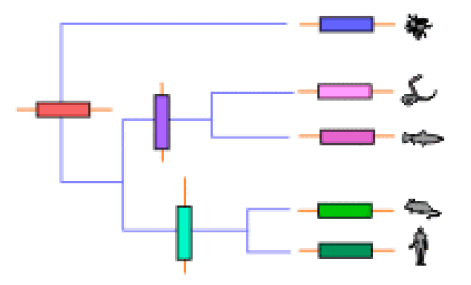
Las 5 proteínas llamadas tripsina en la siguiente tabla son moléculas diferentes: el número de aminoácidos son distintos y sus secuencias, aunque parecidas, presentan diferencias entre sí. Sin embrago, estas proteínas, que son moléculas diferentes, reciben el mismo nombre porque las cinco realizan funciones similares en estos organismos: estas proteínas hidrolizan enlaces peptídicos en las proteínas de la dieta, y rompen un enlace peptídico en el que el lado carboxilo corresponde a un aminoácido básico (lys o arg). Tiene la misma función y actúan de la misma forma. Por otra parte, al comparar las secuencias se pueden agrupar en función de su parecido. Una manera sencilla de visualizar el parecido de sus secuencias es dibujar un diagrama en forma de árbol, en el que se agrupen función de la similtud de sus secuencias. El resultado es un esquema del siguiente tipo:
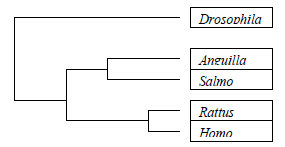
Las tripsinas de rata y humano se parecen mucho entre sí, al igual que las de anguila y salmón (que se diferencian entre sí más que las de los dos mamíferos) Por otra parte, las cuatro tripsinas de vertebrados se parecen entre sí más que a la tripsina de insecto. Obviamente, esto no es casual. Es el resultado del proceso evolutivo.
Atención!
Proteínas homólogas: Son aquellas que provienen de un antepasado común.
Las tripsinas de mamíferos provienen de un antecesor común, así como las de todos los vertebrados y las de los insectos. Al ir evolucionando las especies animales, también fueron variando los genes de sus proteínas, incluyendo en este caso a la tripsina. El resultado es que, cuanto más próximos evolutivamente sean dos organismos, en general más parecidas van a ser sus proteínas, y viceversa (ver tabla I). Esto ha permitido realizar “arboles filogenéticos moleculares. Inicialmente se hicieron empleando las secuencias de aminoácidos de las proteínas.

Este fenómeno ha permitido la realización de “arboles filogenéticos moleculares”, basados en la comparación de secuencias, inicielmente de proteínas, pero actualmente de nucleotidos incluyendo ARN ribosómico o directamente los genes.
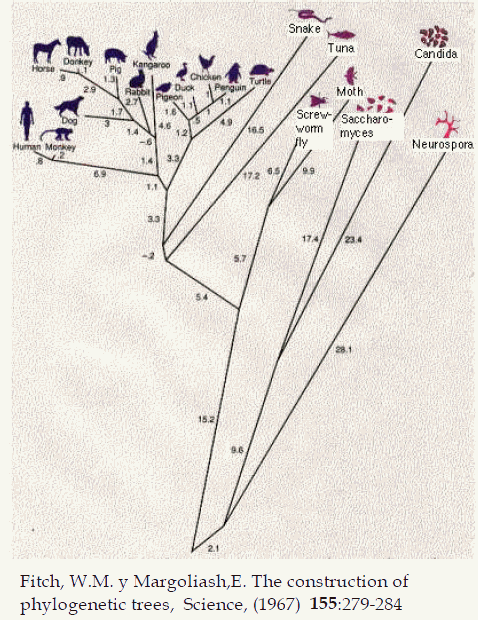
Una versión más completa se muestra a continuación:
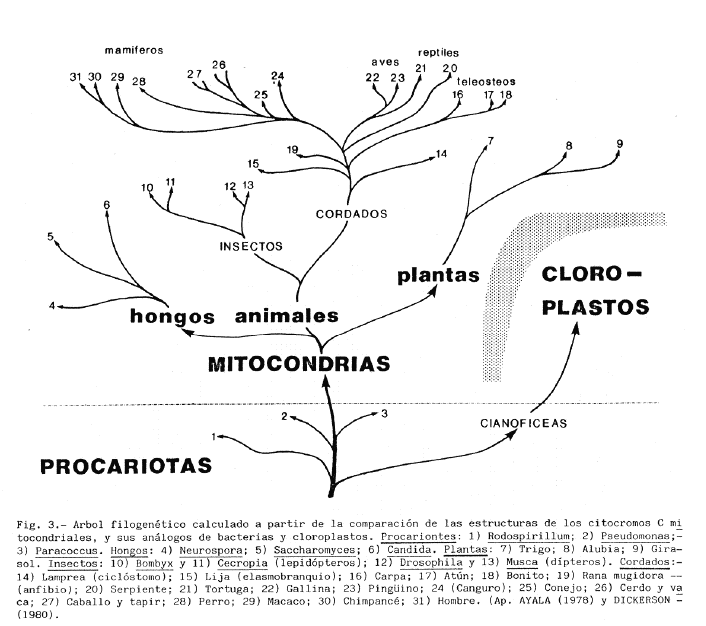
No todas la proteínas ( o sus genes para ser más precisos) cambian a la misma velocidad; hay algunas que han permanecido sin cambios durante periodos de tiempo extremadamente elevados, probablemente porque la función que realizan es crítica y no además no tolera ningún cambio estructural.

Pero no termina aquí esta historia. Al comparar la secuencia de la tripsina humana con la de otras proteínas del mismo origen nos encontramos que hay una serie de proteínas que tienen una función muy parecida, y que además tienen secuencias de aminoácidos similares: por ejemplo, la y la . Esta similitud en la estructura y el parecido en la función indican también que tienen un origen común con la tripsina, aunque en este caso se trate de proteínas que existen simultáneamente en el mismo organismo. También son homólogas de la tripsina.
Atención!
Proteínas HOMOLOGAS: tienen un origen común (si nos remontamos al pasado evolutivo, llegamos a un punto en que los antecesores de ambas proteínas coinciden: tenían el mismo gen)
Hay dos clases diferentes de proteínas homólogas:
- Las que cumplen la misma función (o muy similar) en organismos diferentes: la tripsina humana y la tripsina de rata, por ejemplo, que se llaman Ortólogas. Tienen un antepasado común, porque ambos organismos también lo tenemos.
- Las homólogas dentro de la misma especie se llaman Parálogas, y frecuentemente, aunque no siempre, tienen funciones diferentes; en algún caso, sus funciones muy distintas entre sí. Tienen un antepasado común porque provienen, por duplicación génica, de un gen ancestral y desde la duplicación los dos genes han evolucionado diferentemente.
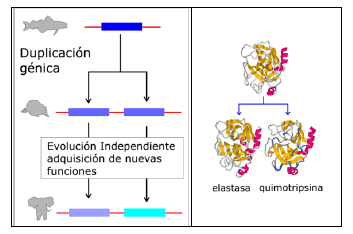
En ambos casos, la homología se manifiesta por similitudes en la secuencia de las proteínas (o de sus genes, claro). En el ejemplo puesto las dos proteínas parálogas tienen funciones similares (son proteasas), y desde hace nucho tiempo se pensaba en un origen común. Pero en otras ocasiones las funciones son tan distintas que hasta no conocer su estructura era completamente impensable pensar en que esas proteínas fuesen homólogas. La duplicación génica permite la aparición de nuevas funciones y la especialización de las proteínas
Un ejemplo de evolución por duplicación génica lo presentan las globinas (mioglobina y hemoglobinas). En el caso humano hay 3 tipos diferentes de hemoglobina: embriónica, fetal y de adulto. Todas son proteínas tetraméricas, pero se diferencian en las cadenas que las forman. Siempre hay dos cadenas de la clase alfa, y dos de la beta, pero en función de la hemoglobina de que se trate las cadenas son unas u otras.